 Phage therapy: Alternative treatment for the Control of Bacterial Infections in Burn patients
Phage therapy: Alternative treatment for the Control of Bacterial Infections in Burn patients
Dra. Cecilia P. Sejas Guzmán
Médico Cirujano
Especialista en Cirugía General
Estudiante de la carrera de Postgrado de Cirugía Plastica y Reparadora
Universidad Del Salvador
Rotacion Quemados – C.E.P.A.Q.- Centro de Excelencia para la Asistencia de Quemaduras – Hospital Alemán
Buenos Aires – Argentina
Ceciita.sg@gmail.com
Resumen
La resistencia a los antibióticos se ha convertido en un importante problema de salud pública a nivel mundial. El tratamiento de pacientes con quemaduras es un proceso complejo que implica un manejo multidisciplinario, multidireccional y multicomponente. Después de la recuperación del shock por quemaduras, las complicaciones infecciosas locales se consideran el principal problema que desacelera el proceso de recuperación y es la principal causa de resultados letales. La susceptibilidad a las infecciones y la creciente resistencia a los antibióticos colocan a los pacientes quemados en mayor riesgo de infecciones por organismos resistentes a múltiples fármacos (MDR). La aplicación en la práctica de fármacos elaborados a partir de bacteriófagos es actualmente cada vez más importante en el manejo de heridas por quemaduras. Los bacteriófagos (fagos) pueden ofrecer un medio “innovador” de tratamiento de infecciones, que puede combinarse o alternarsecon la terapia con antibióticos y puede mejorar nuestra capacidad para tratar infecciones bacterianas con éxito. Este trabajo presenta una revisión exhaustiva de literatura extranjera donde se analiza el papel que desempeña la fagoterapia, como tratamiento alternativo para el control de las infecciones bacterianas en pacientes quemados.
Palabras clave: Quemaduras, resistencia a antibióticos, bacteriófagos, fagoterapia en quemaduras.
Abstract
Antibiotic resistance has become a major public health problem worldwide. Treatment of patients with burns is a complex process that involves multidisciplinary, multidirectional and multicomponent management. After recovery from burn shock, local infections complications are considered the main problem that slows down the recovery process and isthe main cause of lethal outcomes. Susceptibility to infections and increasing resistance to antibiotics places burn patients at increased risk for infections by multidrug resistant organisms (MDR). The practical application of drugs made from bacteriophages is currently increasingly important in the management of burn wounds. Bacteriophages (phages) can offer an “innovative” means of treating infections, which can be combined or alternated with antibiotic therapy and can enhance our ability to treat bacterial infections successfully. This work presents an exhaustive review of foreign literature that analyzes the role of phage therapy as an alternative treatment for the control of bacterial infections in burn patients.
Key words: Burns, antibiotic resistance, bacteriophages, phage therapy in burn.
Introducción
Los bacteriófagos se encuentran entre los organismos más abundantes y ubicuos de la Tierra, son los controladores naturales de las bacterias, los bacteriófagos líticos se replican infectando y multiplicándose dentro de una bacteria específica hasta que la bacteria se destruye, los viriones liberados promueven este ciclo de infección. Se estima que existen en la naturaleza 1 x 1032 fagos. Los fagos fueron descubiertos por primera vez por Frederik Twort en 1915, pero fue descrita por primera vez por Felix d’Herelle en 1917 como un proceso complejo(1). Diez años después de estos descubrimientos, en 1928, Alexander Fleming, descubre la penicilina; con el surgimiento de los antibióticos y su facilidad de uso, la terapia con fagos fue abandonada. Sin embargo, en la década de 1940, el propio Fleming advirtió que el uso indebido de los antibióticos podría resultar en bacterias resistentes a estos.
La resistencia a múltiples fármacos, fue notificada por primera vez en la década de 1970, y se ha convertido hasta hoy en una gran amenaza para el progreso logrado en el control de infecciones a nivel mundial. El Grupo de Coordinación Interinstitucional sobre resistencia a los antimicrobianos (IACG) en el informe para el Secretario General de las Naciones Unidas, del 2019, citaron en uno de los puntos clave del informe que las enfermedades farmacorresistentes ya causan al menos 700.000 muertes al año en todo el mundo, y si no se toman medidas, en el escenario más alarmante la cifra podría aumentar a 10 millones de muertes al año para 2050. Alrededor de 2,4 millones de personas podrían morir en los países de ingresos altos entre 2015 y 2050 si no hay un esfuerzo sostenido por contener la resistencia a los antimicrobianos(2).
En las unidades de quemados, una gran cantidad de infecciones son causadas por bacterias multirresistentes. Mientras que Staphylococcus aureus sigue siendo un colonizador temprano común de heridas por quemaduras, la infección por Pseudomona aeruginosa se conoce como la causa más común de infección potencialmente mortal en pacientes quemados(3,4). Ambas bacterias, pero especialmente P. aeruginosa, son conocidas por su resistencia intrínseca y adquirida a muchos antibióticos. Se ha informado con frecuencia que las cepas de P. aeruginosa multirresistente causan brotes nosocomiales de infección en las unidades de quemados(5,6).
Con la aparición de la resistencia a los antibióticos, la terapia con fagos ahora parece ser una alternativa prometedora a los antibióticos, con algunos informes de casos exitosos(7,8) respaldado por una gran base de conocimientos fundamentales.
Los pocos artículos de la literatura científica sobre terapia con fagos relacionados con heridas por quemaduras(9-18), sugieren que los fagos podrían tener el potencial de controlar la infección bacteriana de la herida por quemadura.
Objetivo general
El objetivo general de esta revisión bibliográfica es analizar el papel que puede desempeñar la fagoterapia, como tratamiento alternativo para el control de las infecciones bacterianas en pacientes quemados.
Objetivos específicos
• Revisar artículos, ensayos clínicos actualizados y casos documentados.
• Discutir la eficacia de la fagoterapia como alternativa en el tratamiento de pacientes quemados y su evolución hacia nuevas estrategias como la terapia combinada de fagos y antibióticos, así como su uso endovenoso.
• Evaluar los aspectos claves que apoyan el uso de fagos frente a los antibióticos y los inconvenientes que se han de superar para su implantación efectiva.
Métodos y Materiales
Para la realización de este trabajo se ha llevado a cabo una búsqueda bibliográfica utilizando las siguientes bases de datos: PubMed, Web ofSciencey Sciencedirect. Comenzando la búsqueda con palabras claves muy generales, como “bacteriophages”, “phagetherapy”, y “phagoburn” se obtuvieron los primeros documentos de carácter general. A estos documentos se les sumaron otros de temática más específica según se profundizaba en cada uno de los puntos de este trabajo. Además de la búsqueda en la literatura disponible se realizaron lecturas de libros de microbiología y virología para lograr disponer de información más precisa y actualizada.
Finalmente se han consultado diferentes páginas webs oficiales, que se encuentran especificadas en la bibliografía, de las que se ha recopilado información de gran utilidad para esta revisión bibliográfica.
Resultados y Discusión
1.1. Resistencia Antimicrobiana
Poco después del descubrimiento de Alexander Fleming en 1928 de la penicilina yel comienzo del uso generalizado de antibióticos en la medicina occidental. En la década de 1940, el propio Fleming advirtió que el uso indebido de estos medicamentos podía resultar en bacterias resistentes a los antibióticos. Como se predijo, empezaron a surgir informes clínicos de resistencia a los antibióticos, como la evolución de Mycobacterium tuberculosis resistente, en los primeros ensayos clínicos sobre la eficacia de la estreptomicina en el tratamiento de la tuberculosis(19). El descubrimientoy el desarrollo de nuevos antibióticos floreció durante muchas décadas(20). Sin embargo, a finales del siglo XX, el descubrimiento de antibióticos se ralentizó y el alarmante aumento de las tasas de resistencia a los antibióticos indicó que la edad de oro de los antibióticos quizás había terminado. De hecho, aparte de las tres nuevas clases de antibióticos descubiertas entre 2005 y 2018, no se han desarrollado nuevas clases de fármacos desde la década de 1980(21-23). Un mecanismo de acción similar entre estos fármacos más nuevos ha conducido a una posible evolución de la resistencia cruzada en bacterias. Si bien las modificaciones sintéticas de algunos antibióticos preexistentes han ampliado temporalmente su utilidad clínica(24), este enfoque también ha seleccionado mecanismos de resistencia más amplios, como betalactamasas de amplio espectro(25), cambios adaptativos que tal vez se desarrollen más fácilmente en comparación con los mecanismos de resistencia de novo.
La mayoría de las nuevas clases de antibióticos se dirigen a las bacterias Gram positivas, pero el principal desafío es encontrar nuevos antibióticos contra las bacterias Gram negativas, calificadas por la Organización Mundial de la Salud (OMS) como prioridad crítica en su lista de patógenos prioritarios para Investigación y desarrollo de nuevos antibióticos(26).
En este sentido se ha visto, en las unidades de quemados, que la susceptibilidad a las infecciones y la creciente resistencia a los antibióticos colocan a los pacientes quemados en mayor riesgo de infecciones por organismos resistentes a múltiples fármacos (MDR). En la práctica clínica, los defectos de la herida se consideran colonizados por microorganismos MDR si los cultivos de S. aureus resistente a meticilina, o enterococos resistente a la vancomicina y/o microorganismos resistentes a las β-lactamasas (BLEE) se aíslan durante la inoculación. Pseudomona aeruginosa, S. aureus, y Acinetobacter baumannii, están establecidos como los agentes etiológicos más comunes de complicaciones infecciosas locales en pacientes quemados, siendo la infección por Pseudomona aeruginosa la más común. Las infecciones por MDR se asocian con un mayor número de procedimientos quirúrgicos, mayor duración de la ventilación mecánica, más días de antibióticos y hospitalización más prolongada(27).
La evolución de las bacterias multirresistentes y la dificultad para desarrollar nuevos antibióticos amenazan el control de las enfermedades infecciosas y nos apremia a desarrollar herramientas terapéuticas alternativas. En este sentido, los fagos representan una fuente especialmente prometedora de nuevas herramientas para combatir la resistencia microbiana(28).
1.2. Fagoterapia: Historia
Durante la Primera Guerra Mundial se difundieron noticias bastante sensacionales: los virus “comedores de microorganismos” fueron descubiertos por Felix d’Herelle, que desarrolló una preparación de fagos para tratar a los soldados de la Primera Guerra Mundial afectados por disentería. Los médicos de todo el mundo estaban entusiasmados con esta noticia, sobre todo porque los informes publicados en revistas médicas daban cuenta que los virus bacteriófagos eran inofensivos para los seres humanos y los animales, y podían aplicarse con éxito como medios terapéuticos.
En realidad, la historia de los bacteriófagos comenzó mucho antes de este evento.En 1896, el bacteriólogo inglés Ernest Hanbery Hankin intentó enumerar el número de Vibrio cholera en un milímetro cúbico de agua en el río Ganghes. Se tomaron muestras en los lugares donde el río entra y sale de la ciudad de Agra. Sorprendentemente, Hankin (1896) contó 100.000 unidades infecciosas en un milímetro cúbico de agua en la entrada de la ciudad, mientras que su número disminuyó a solo 90 donde el río salía de la ciudad. Esta extraña autopurificación de Ganghes no pudo encontrar su explicación en ese momento y fue referida como “el fenómeno de Hankin”. En 1906-1909, Félix d’Herelle viajó por México, donde conoció a un entomólogo que le llamó la atención sobre las violentas epidemias de langostas. d’Herelle aisló la bacteria Coccobaccilus aeridiorum (actualmente conocida como Enterobacter aerogenes). Motivado por un deseo ambicioso de utilizar estas bacterias deliberadamente contra las plagas de langostas, llevó a cabo una serie de experimentos en Túnez y Guyana. Durante estos experimentos, d’Herelle observó la aparición de manchas transparentes o blancas (vírgenes) (“taches vierges”) en el cultivo bacteriano. Supuso que fueron causados por un virus que se suponía erróneamente que era la causa de la infección por langostas. d’Herelle aisló este virus y lo utilizó contra la langosta, pero sin éxito. Comenzó a perseguir la idea de utilizar de nuevo la bacteria huésped contra la langosta y no tomó en consideración los extraños “taches vierges”.
En 1915, la conocida revista británica The Lancet publicó un artículo escrito por Frederick Twort sobre “las lisis bacterianas transmisibles”, en el que Twort describía su observación de “los bordes comidos de las colonias de Staphylococcus”. Logró filtrar los cultivos apropiados de Staphylococcus y divisó el filtrado en el cultivo de diferentes cepas de Staphylococcus. Por lo tanto, recibió una zona clara de lisis una y otra vez. Sin embargo, Twort no pudo explicar el evento observado y proporcionó solo su descripción. Esta fue la primera publicación sobre bacteriófagos. d’Herelle leyó este artículo, que le recordó sus propias observaciones en México y Túnez. Sospechaba que el agente filtrado era un virus bacteriano, un invasor invisible que destruye las bacterias.
El descubrimiento o redescubrimiento de bacteriófagos por Felix d’Herelle después de Frederick Twort se asocia con frecuencia con un brote de disentería hemorrágica grave entre las tropas francesas estacionadas en Maisons-Laffitte (en las afueras de París) en julio de 1915. Varios soldados fueron hospitalizados y se asignó a d’Herelle para que llevara a cabo una investigación del brote. Durante estos estudios, hizo filtrados libres de bacterias de las muestras fecales de los pacientes y las mezcló e incubó con cepas de Shigella aisladas de los pacientes. Una parte de las mezclas se inoculó en animales de experimentación (como parte de los estudios de d’Herelle sobre el desarrollo de una vacuna contra disentería bacteriana), y una porción se extendió en medio de agar para observar el crecimiento de la bacteria. En estos cultivos de agar, d’Herelle observó nuevamente la aparición de áreas pequeñas y claras, que inicialmente llamó taches, luego taches vierges y, más tarde, placas. Los hallazgos de d’Herelle se presentaron durante la reunión de septiembre de 1917 de la Academia de Ciencias y posteriormente se publicaron en las actas de la reunión. A diferencia de Hankin y Twort, d’Herelle tenía pocas dudas sobre la naturaleza del fenómeno, y propuso que era causado por un virus capaz de parasitar bacterias. d’Herelle también propuso el nombre “bacteriófago” (de “bacteria” y del griego ![]() phagein “comer”).
phagein “comer”).
El descubrimiento de bacteriófagos fue inevitable. Diversos científicos han observado fenómenos similares en regiones remotas del mundo. A finales del siglo XIX, N.F. Gamaleya (más tarde miembro honorario de la Academia de la URSS) publicó un artículo en los Archivos Rusos de Medicina Patológica y Clínica. En este artículo describió la lisis de Bacillus antracis en agua destilada, después de lo cual el agua obtuvo la capacidad de lisar otras cepas de B. antracis. En 1917, un joven científico georgiano George Eliava había observado la misteriosa desaparición de células de V. cholera(29).
El mayor mérito de Felix d’Herelle es que propuso la idea de utilizar bacteriófagos para el tratamiento de enfermedades bacterianas humanas y animales. Por esta idea mereció el Premio Nobel, al que fue nominado ocho veces, cada año desde 1925, aunque nunca fue galardonado con uno [citado por Hausler (2008) según Nobel Archives].
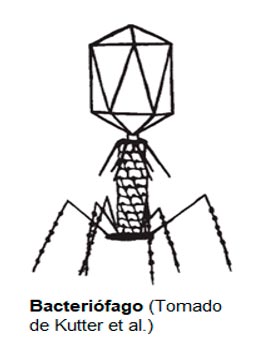 1.3. Biología de Fagos
1.3. Biología de Fagos
Los bacteriófagos o fagos son virus que infectan y lisan bacterias de manera específica. Esencialmente constan de un genoma vírico de ADN o ARN de cadena simple o doble, protegido por una cubierta proteica denominada cápside. Los fagos son la forma de vida más abundante y ubicua en la tierra, con una población estimada de entre 1030 y 1032 Unidades Formadoras de Placa (UFP) en toda la biosfera y juegan un papel fundamental manteniendo el equilibrio poblacional de las bacterias en los ecosistemas.
Los fagos se pueden caracterizar por la geometría de su cápside en: icosaedricos, filamentosos y complejos. Los miembros de estos grupos pueden tener ácido nucleico de varios tipos: ADN monocatenario, ADN bicatenario, ARN monocatenario y ARN bicatenario. Además, como parásitos intracelulares obligados de bacterias, los fagos pueden presentar diferentes ciclos de vida en la célula hospedadora: lítico, lisogénico, pseudolisogénico e infección crónica.
Durante un ciclo de infección lítica (Figura 1), un fago (1) se unirá al receptor o receptores en la superficie de la bacteria; (2) entrega el contenido genómico a la bacteria; (3) ocurre la replicación viral en el citosol a través de la transcripción, traducción y replicación bacteriana; y (4) tras la formación de nuevas partículas de fagos, escapan del citoplasma mediante la lisis de la bacteria. A continuación, las nuevas partículas de fagos repiten este proceso a medida que infectan células susceptibles adicionales. Esto pone de relieve un beneficio de la terapia con fagos que se ha comprendido desde hace mucho tiempo: utilizar virus líticos como “fármacos” autoamplificadores que se dirigen a las células susceptibles y las destruyen puede ser más eficaz que aplicar antibióticos que son incapaces de autoamplificarse. Los fagos obviamente líticos (o “virulentos”) parecen ser los mejores candidatos para el desarrollo de la terapia con fagos. Sin embargo, para completar, recordamos brevemente que los fagos lisogénicos (o templados) también prevalecen en la naturaleza. Los fagos lisogénicos se integran en el genoma del huésped y son heredados por las células hijas durante la fisión binaria; sin embargo, en un momento posterior, bajo perturbación ambiental u otro factor de estrés fisiológico, el fago lisogénico se escinde del genoma bacteriano y entra en un ciclo de infección lítica. Si bien los fagos lisogénicos pueden ser preferidos en ciertas aplicaciones biotecnológicas, los fagos líticos son más parecidos a los antibióticos letales para las bacterias, lo que sugiere un camino más fácil de aprobación para el tratamiento de infecciones bacterianas(30).

1.4. Experiencia en ensayos clínicos
La capacidad de caracterizar y probar los fagos como terapias antimicrobianas ha avanzado enormemente. La era actual ofrece la secuenciación completa del genoma a bajo costo, tecnología automatizada para medir el crecimiento de microbios y métodos eficientes de alto rendimiento para examinar cientos o incluso miles de muestras simultáneamente. Mientras tanto, se reconoce cada vez más que los ensayos clínicos modernos deben diseñarse cuidadosamente para que sean más seguros, más inclusivos y (si es posible) para generar datos valiosos en comparación con los intentos anteriores(30).
El tratamiento de todo tipo de infecciones bacterianas con bacteriófagos comenzó ya en los años 20 del siglo XX. Desde entonces, se han utilizado en Rusia, Georgia, Polonia y otros países. Los científicos rusos están estudiando activamente la posibilidad de utilizar bacteriófagos para tratar infecciones causadas por agentes resistentes a los antibióticos(31-36). En los últimos años, también se ha observado en todo el mundo un creciente interés por los bacteriófagos. Una de las principales organizaciones científicas dedicadas al estudio de los bacteriófagos sigue siendo el Instituto de Bacteriófagos, Microbiología y Virología G. Eliava en Tbilisi (Georgia). En el Instituto de Inmunología y Terapia Experimental Ludwik Hirszfeld en Wroclaw (Polonia) se está llevando a cabo un trabajo serio sobre el estudio de la terapia con fagos. Sin embargo, cabe subrayar que en Europa la aparición de antibióticos con un espectro de actividad más amplio y más fáciles de producir en grandes cantidades (es decir, comercialmente más rentables) ha obligado a la terapia con fagos a la periferia de la ciencia médica.
1.4.1. Bacteriófagos en el tratamiento de pacientes quemados
El tratamiento de pacientes con quemaduras es un proceso complejo que implica un manejo intensivo multidireccional multicomponente de la mayoría de los órganos y sistemas dañados por efectos térmicos en la piel, alternando con intervenciones quirúrgicas repetidas destinadas a eliminar tejidos no viables con posterior cierre plástico de los defectos de la herida. Después de la recuperación del shock por quemaduras, las complicaciones infecciosas locales se consideran el principal problema que desacelera el proceso de recuperación y es la principal causa de resultados letales. Ya que la integridad de la piel se rompe, los microorganismos penetran fácilmente en el ambiente interno del organismo humano dando como resultado un estado séptico con falla multiorgánica. La susceptibilidad a las infecciones y la creciente resistencia a los antibióticos colocan a los pacientes quemados en mayor riesgo de infecciones por organismos resistentes a múltiples fármacos (MDR).
La introducción en la práctica de fármacos elaborados a partir de bacteriófagos es actualmente cada vez más importante en el manejo de heridas por quemaduras. Esto está confirmado por el creciente interés en este campo de la farmacología, el desarrollo de programas especiales dirigidos al estudio de los procesos de fagos e interacción de células bacterianas.
En la literatura científica se presentan varios trabajos experimentales sobre fagoterapia en heridas por quemaduras que sugieren un efecto potencialmente exitoso de la aplicación de bacteriófagos en esta patología.
En los estudios de McVay et al y Kumari et al, en modelos murinos mostraron que, en quemaduras profundas, la aplicación de fagos puede reducir la letalidad de la infección causada por P. aeruginosa y K. pneumoniae(9,11). Además concluyeron que los bacteriófagos son seguros y eficaces en la eliminación completa de la infección por Klebsiella, por lo que reforzó la opinión de que la terapia con fagos puede usarse para tratar infecciones bacterianas de sitios quemados, especialmente en situaciones en las que la resistencia a los antibióticos obstaculiza la línea rutinaria de tratamientos.
En el estudio de Soothil(13), se comprobó la eficacia del empleo de bacteriófagos en el injerto de piel parcial, complicado por infección por P. aeruginosa, en el modelo experimental de una herida por quemadura en cobayos. Se comprobó que la infección de los injertos con P. aeruginosa los destruye, mientras que un bacteriófago lítico específico (Fago BS24) evita la destrucción durante el cierre de la quemadura contaminada.
En el estudio reciente de Kumari et al(10), la eficacia de un bacteriófago específico para el tratamiento de la infección de heridas en ratones inducida por K. pneumoniae se ha comparado con la del nitrato de plata y la gentamicina. En el experimento in vivo, se modeló una quemadura profunda y la herida se infectó con K. pneumoniae. Después del desarrollo del proceso de infección, las preparaciones probadas se aplicaron tópicamente sobre la herida por quemadura. La letalidad sirvió como criterio de eficacia. Los resultados han demostrado que una sola dosis de fago condujo a una reducción significativa de la letalidad (p <0,001). La aplicación múltiple de nitrato de plata y gentamicina a dosis de 0,5% y 1000 mg / L, respectivamente, también proporcionó una protección significativa (p <0,001). Sin embargo, el nivel de defensa proporcionado por estos dos agentes fue menor que el de la fagoterapia. Los resultados indican que el fago es una perspectiva para el tratamiento de las infecciones por quemaduras, ya que su aplicación tópica única podría reducir la letalidad en ratones causada por la infección por K. pneumoniae en comparación con el uso múltiple de nitrato de plata y gentamicina.
Golkar et al(36),demostraron la eficacia del tratamiento con fagos en un modelo murino, después de la infección superficial con MDR de P. aeruginosa, el ensayo mostró que la administración del fago lítico PS5 en el animal infectado resolvió la infección (Figuras 2,3). Los resultados mostraron que la administración de fagos 30-45 minutos después de la exposición bacteriana fue muy eficaz. Además, las bacterias y el fago se transfirieron inmediatamente a la sangre, ya que se supone que esta es la situación in vivo más adecuada para la interacción entre el fago y la bacteria. También se probó la eficacia del fago PS5 en la infección cutánea bacteriana crónica (Figuras 4, 5). En estos animales, la lesión no fue eliminada por el sistema inmunológico de los animales, pero la curación fue evidente por los fagos líticos. Demostraron una recuperación completa en animales infectados crónicamente con MDR después del tratamiento.
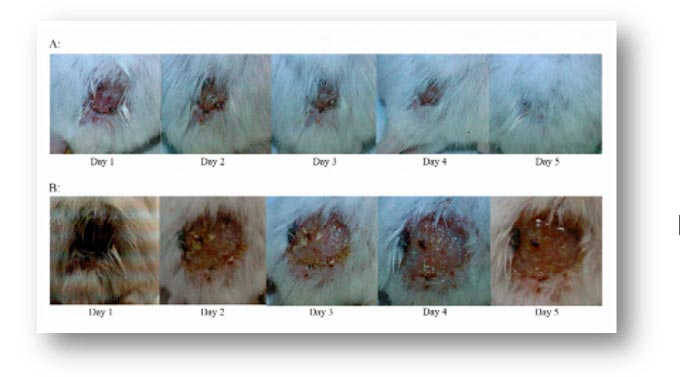
A: Aplicación de fagos y tiempo necesario para curar la lesión en la espalda del animal.
B: Control de animales infectados con MDR Pseudomonas aeruginosa.

A: Aplicación de fagos y tiempo necesario para curar la lesión en la espalda del animal.
B: Control de animales infectados con MDR Pseudomonas aeruginosa sin fagoterapia.
La recuperación de los animales se logró mediante la administración de dos dosis de fagos al día durante una semana y manteniendo una infusión continua de fagos vía oral. La eficacia del fago lítico PS5 en el tratamiento del modelo murino infectado experimental exhibido por P. aeruginosa MDR en estos animales sugirió fuertemente que P. aeruginosa MDR es susceptible tanto para aplicaciones orales como intraperitoneales del fago lítico PS5. La eficacia del tratamiento con fagos fue evidente en las lesiones crónicas (dentro de los 6 días) después del tratamiento, determinado por la recuperación completa de los roedores infectados. Es de destacar que el modelo de infección crónica imitaría de cerca la condición humana real, cuando un paciente infectado al que se le diagnosticó una infección por MDR sería un candidato para la terapia con fagos.
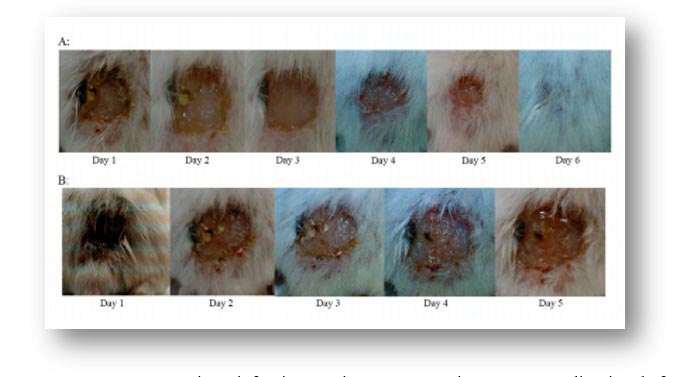
A: Aplicación de fagos y tiempo necesario para curar la lesión en la espalda del animal.
B: Control de animales infectados con MDR Pseudomonas aeruginosa sin fagoterapia.
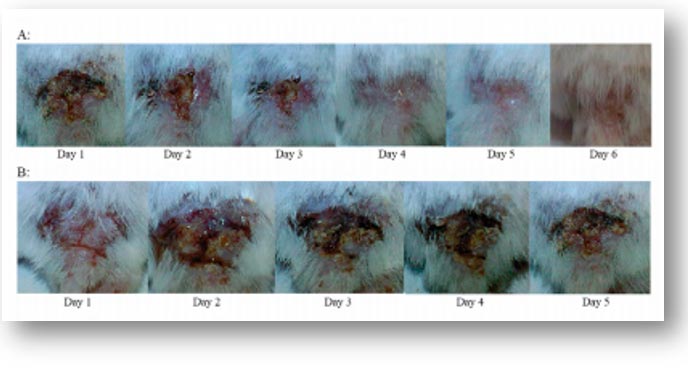
A: Aplicación de fagos y tiempo necesario para curar la lesión en la espalda del animal.
B: Control de animales infectados con MDR Pseudomonas aeruginosa sin fagoterapia.
Holguín et al.(37) han realizado un análisis bacteriológico cuantitativo, control de biopelículas, utilizando microscopía electrónica de transmisión, electroforesis en gel en el campo pulsado, y han estudiado la actividad biológica del fago ΦPan70 in vivo, en heridas por quemadura en ratones. Los resultados obtenidos demostraron que el fago en relación con las células de plancton y las biopelículas redujo considerablemente la población bacteriana. En el grupo principal, la supervivencia de los animales fue del 80 al 100%, siendo significativamente diferente del control (0%). En este estudio, este nuevo fago de P. aeruginosa mostró una eficiente actividad de control bacteriana en los diferentes ensayos. Sin embargo, hallazgos posteriores del genoma sugirieron que es un fago templado, lo que lo hace inadecuado para la terapia con fagos. Este trabajo destaca la importancia de la secuenciación del genoma de fagos para su uso como alternativa terapéutica, antes de nuevos experimentos. ΦPan70, que parecía ser un candidato ideal para controlar P. aeruginosa MDR, parece ser un fago templado según su anotación genómica. Los fagos templados deben evitarse como agentes terapéuticos debido a una variedad de características desventajosas que pueden comprometer la seguridad y la salud de un paciente.
En el ensayo clínico realizado por Lazareva et al.(38) se presentan los resultados de la evaluación clínica y de laboratorio del tratamiento con piobacteriófagos en tabletas de los pacientes con heridas por quemaduras. Se demostró que la fagoterapia proporcionó una cura más rápida de las complicaciones piosépticas, normalización de la temperatura, purificación de las heridas y menor letalidad. El análisis bacteriológico de las secreciones de la herida reveló que después del tratamiento, los estafilococos y estreptococos se cultivaron 2 veces en raras ocasiones, Proteus spp. se aislaron 1,5 veces en raras ocasiones, no se aisló E. coli. La cantidad de hemocultivos positivos también disminuyó. La investigación del estado inmunológico demostró una normalización estadísticamente significativa de la inmunidad a nivel celular. El nivel de fagocitosis no cambió mientras que en el grupo de control (sin uso de bacteriófagos) se redujo. Los resultados del ensayo demuestran el efecto positivo de la aplicación de la fagoterapia a los pacientes con quemaduras.
La terapia con fagos es una alternativa prometedora para dificultar la progresión de bacterias patógenas. Sin embargo, la resistencia bacteriana de fagos ya es bien conocida,
Chada et al., demostraron en su estudio que el uso de cócteles de fagos puede superar este inconveniente. El objetivo del estudio fue evaluar la eficacia terapéutica del monófago (Kpn1, Kpn2, Kpn3, Kpn4 y Kpn5) en comparación con el cóctel de fagos para resolver el curso de la infección por quemaduras en ratones. Aunque, los animales que recibieron terapia con monófagos mostraron eficacia para resolver el curso de la infección, el cóctel de fagos fue muy eficaz para detener todo el proceso de infección (carga bacteriana, contracción de la herida, actividad mieloperoxidasa de la piel, formación de colágeno y análisis histopatológico). En comparación con los ratones de control no tratados, se obtuvo una reducción significativa en la carga bacteriana en los animales tratados con Kpn1, Kpn2, Kpn3, Kpn4 y Kpn5, respectivamente. Sin embargo, el grupo que recibió el cóctel de fagos mostró una reducción máxima de la carga bacteriana en el tejido de la piel. La carga bacteriana se redujo significativamente. Por tanto, el cóctel de fagos proporcionó la máxima protección contra la infección de la herida por quemadura por K. pneumoniae B5055. En comparación con cualquier fago individual, el cóctel de fagos verificó significativamente la aparición de mutantes resistentes. Por lo tanto, este enfoque puede servir como una estrategia eficaz en el tratamiento de infecciones de heridas por quemaduras mediadas por Klebsiella en personas que no responden a la terapia con antibióticos convencional.
Los investigadores polacos Górskiet al.(39) realizaron más de 280 procedimientos con aplicación de fagos en pacientes que fueron tratados sin éxito con métodos tradicionales. La fagoterapia pareció ser eficaz en el 40% de los pacientes con resultados negativos de otros tipos de tratamiento. En este grupo, la fagoterapia resultó en la eliminación completa de patógenos o en una mejora clínica constante. En el 60% restante de los pacientes se observaron resultados ambiguos, ausencia de efectos terapéuticos o incluso empeoramiento después de la fagoterapia. En las otras investigaciones de estos autores(40,41), los datos obtenidos han demostrado la capacidad de los fagos (y sus proteínas) para suprimir citocinas proinflamatorias en ratones y formas activas de oxígeno. También se observaron resultados similares en pacientes que recibieron terapia con fagos(42), lo que sugiere que los fagos, además de su efecto antibacteriano comúnmente conocido, pueden ejercer un efecto antiinflamatorio y efectos inmunomoduladores(43-45).
Científicos de Portugal(46) presentaron una descripción general sobre la aplicación de bacteriófagos para el control y la prevención de la formación de biopelículas bacterianas. Se ha observado que los fagos pueden usarse por separado, como un cóctel para expandir el espectro de actividad o en combinación con otras preparaciones antimicrobianas.
Investigadores de Egipto, Sarhan et al.(47) compararon los materiales para apósitos de heridas a base de nanofibras biocompatibles multicomponentes con la adición de bacteriófagos y sin ellos. Entre las diferentes formulaciones de nanofibras, la miel, el alcohol polivinílico, el veneno de abeja / bacteriófago de quitosano exhibieron la actividad antibacteriana más potente contra todas las cepas bacterianas probadas (cepas grampositivas y negativas) y lograron la muerte casi completa de P. aeruginosa resistente a múltiples fármacos. Las pruebas in vivo revelaron mejores resultados en la cicatrización de heridas y las pruebas de citotoxicidad demostraron una mejor biocompatibilidad. Los autores han llegado a la conclusión de que el desarrollo de cubiertas para heridas que contienen bacteriófagos es una dirección prometedora.
Un grupo de científicos de Turquía(48) ha estudiado in vitro la sensibilidad de los microorganismos resistentes, aislados de pacientes con infecciones complicadas de tejidos blandos, a los cócteles estándar de bacteriófagos (fagos). Los resultados demuestran un alto potencial de la terapia tópica con bacteriófagos en el tratamiento de infecciones complicadas de tejidos blandos. Estos resultados son prometedores, especialmente para las infecciones causadas por patógenos MDR que son difíciles de tratar. Dado que este es un paso preliminar para los posibles ensayos clínicos que se diseñarán, la confirmación in vitro de su éxito debe aceptarse como una acción inicial, lo que es alentador para considerar especialmente los ensayos clínicos de terapia con fagos, en países que no están introduciendo la terapia con fagos.
Los especialistas del Instituto de Trasplantes de la Universidad Médica de Varsovia (Polonia) creen que la administración de virus fagos a los pacientes trasplantados es segura porque, a diferencia de otros virus, no aumentan el riesgo de rechazo del trasplante. Existe evidencia de que los virus de fagos pueden causar un efecto inmunosupresor aumentando la probabilidad de injerto en el trasplante. Los bacteriófagos inhiben considerablemente la activación y proliferación de las células T, así como la activación del factor de transcripción nuclear NF-kB en respuesta a un patógeno viral. La introducción del fago in vivo podría disminuir la infiltración celular del aloinjerto de piel. Los datos presentados en el trabajo de Gorski et al.(49) han demostrado que los fagos pueden usarse en trasplante clínico para tratar infecciones causadas por bacterias resistentes y posiblemente ser un medio complementario de terapia inmunosupresora. Algunos investigadores creen que la producción de bacteriófagos pronto se convertirá en una de las ramas líderes de la industria farmacéutica(50).
Un proyecto interesante para investigar el potencial del uso de bacteriófagos para heridas por quemaduras es un estudio controlado aleatorio PhagoBurn (www.phagoburn.eu) que fue financiado por la Comisión Europea y se lanzó en 2013 con la participación de Francia, Bélgica y Suiza. El proyecto permitió a los científicos evaluar la eficacia de la terapia con fagos en el tratamiento de heridas por quemaduras infectadas con P. аeruginosa(51). Encontraron que la carga bacteriana diaria en la herida más infectada se redujo con éxito en la mitad de los participantes al final del tratamiento con fagos. Sin embargo, el tiempo medio para alcanzar este criterio de valoración fue significativamente más largo para los del grupo que se les aplicó el fago PP1131 que paralos del grupo de atención estándar. Este resultado fue independiente del uso sistémico de antibióticos activos contra la cepa infectante, ya sea en curso el día 0 o introducido más tarde durante el tratamiento del estudio. Esta es la primera vez que se ha observado una reducción clínicamente relevante en la carga bacteriana en un ensayo clínico después de 7 días de aplicación tópica de fagos.
Hasta donde se sabe, PhagoBurn es el primer ensayo clínico de terapia con fagos que sigue buenas prácticas clínicas. El estudio se centró en las infecciones graves por quemaduras porque la infección de las heridas es una de las principales causas de morbilidad y mortalidad después de un traumatismo por quemaduras y, a menudo, es causada por bacterias multirresistentes(51).
El tratamiento con fagos fue diseñado para ser aplicado tópicamente, evitando una inyección sistémica, que las agencias consideraron demasiado arriesgada en 2013 cuando se propuso por primera vez el diseño de este estudio. Una inyección de fagos sistémica era potencialmente más propensa a eventos adversos asociados con residuos de endotoxinas que un tratamiento tópico, por lo que, para cumplir con las buenas prácticas de fabricación, diseñaron un tratamiento tópico.
Este estudio tuvo varias limitaciones y encontró muchas dificultades inesperadas, entre algunos: los grupos de tratamiento estaban desequilibrados a pesar de la asignación al azar. Los participantes del grupo PP1131 tenían menos quemaduras y eran mayores que los del grupo de atención estándar. La edad y la escala de las quemaduras son factores clave de riesgo de la gravedad de las mismas; por otro lado remarcaron la importancia de realizar pruebas preliminares de fagosusceptibilidad (es decir, los llamados fagogramas) por lo que indican realizar estos en ensayos futuros antes de aplicar un tratamiento con fagos; otro inconveniente que encontraron durante el ensayo clínico se debió a los problemas de estabilidad del cóctel de fagos, esto dio como resultado la administración de una dosis de fagos activos de 1000 a 10000 veces menor a los pacientes del grupo PP1131. Esta baja dosis de fagos, en combinación con la alta carga bacteriana en el grupo PP1131, dio como resultado una baja multiplicidad de infección de fagos a bacterias (1: 10000) en el sitio de la herida. Esto fue uno de los principales motivos por los que el patrocinador decidió terminar el estudio antes de tiempo en 2017.
Por otro lado, los componentes del fago en PP1131 no provocaron problemas de seguridad, lo que concuerda con los perfiles de seguridad favorables documentados de los bacteriófagos(52-54).
Las complicaciones sépticas más graves, incluido el shock séptico y las complicaciones infecciosas, aparecieron con el doble de frecuencia en el grupo de atención estándar que en el grupo PP1131. Este resultado fue clínicamente sorprendente porque esperaban que se produjera un empeoramiento de la sepsis en el grupo formado por personas mayores para quienes la tasa de reducción bacteriana se redujo con PP1131 y que tenían la mayor carga bacteriana inicial. La barrera cutánea se destruye en las quemaduras graves, aumentando la absorción sistémica de los productos tópicos. Los aparentemente pocos eventos adversos sépticos graves observados en el grupo de PP1131 los llevaron a plantear la hipótesis de un efecto clínico através del paso sistémico de fagos con una posible estimulación inmune(55,56).
La bioproducción de fagos para la terapia con fagos y los ensayos clínicos, independientemente del tipo de preparación (magistral o lista para usar), debe cumplir con los estándares de buenas prácticas de fabricación y estar aprobada por las autoridades sanitarias nacionales(57). Después de mejoras sustanciales en el proceso de desarrollo, que se centró en reducir la concentración de endotoxinas residuales (en más de 1000 veces) y otros restos bacterianos, la terapia con fagos pasó de ser un tratamiento exclusivamente tópico en 2015 a un tratamiento intravenoso en 2017; por lo tanto, en estudios futuros que exploren la terapia con fagos, se debe considerar el uso de formulaciones intravenosas(58).
Por último, en Australia, actualmente se encuentra en estudio un ensayo clínico en fase I, aleatorizado, abierto, controlado activo. El objetivo central de este ensayo es investigar la seguridad y tolerabilidad de PhageCocktail-SPK como complemento de la terapia estándar para la prevención y el tratamiento de quemaduras de segundo grado susceptibles de infección o infectadas por S. aureus, P. aeruginosa o K. pneumoniae, en pacientes adultos. Dicho estudio se tiene como previsto que concluirá en Agosto de 2023(59).
Conclusiones
Los bacteriófagos están ocupando con seguridad uno de los lugares principales en la fila de preparaciones antibacterianas y la fagoterapia se convierte cada vez más, en un componente del manejo exitoso de pacientes con infecciones MDR.
El creciente número de publicaciones refleja sin duda un creciente interés de especialistas de diferentes países por la aplicación de bacteriófagos en el tratamiento de heridas complicadas, incluidas las de pacientes quemados.
En la actualidad, la base de evidencia en relación al potencial terapéutico de los bacteriófagos en el tratamiento de pacientes quemados se ha formado principalmente por los casos descritos de sus aplicaciones exitosas en la práctica clínica, estudios experimentales in vitro e in vivo, y está orientada en muchos aspectos a la opinión de expertos. Parece de suma importancia continuar las investigaciones sobre la posibilidad de aplicación y eficacia de la fagoterapia en el tratamiento de las infecciones por quemaduras en el marco de estudios epidemiológicos y clínicos con un diseño más sofisticado.
Los fagos nos aportan una gran cantidad de recursos y nuevas estrategias terapéuticas que deben incluirse en nuestro repertorio de tratamientos contra las bacterias resistentes a antibióticos. No obstante, se deben llenar algunas lagunas de conocimiento antes de que podamos estandarizar el manejo terapéutico de los fagos y establecer marcos legales adecuados. El renovado interés en el campo de la terapia con fagos nos da razones para ser optimistas de que estos desafíos se pueden enfrentar en los próximos años.
Bibliografía
- d’Herelle F, Smith GH. The bacteriophage: its role in immunity, English edition. Baltimore, MA: Williams & Wilkins Company, 1922.http://archive.org/details/cu31924003218991
- Grupo Especial de Coordinación Interorganismos sobre Resistencia a los Antimicrobianos, Informe No podemos esperar: Asegurar el futuro contra las infecciones farmacorresistentes. 2019.https://www.who.int/antimicrobial-resistance/interagency-coordination-group/IACG_final_report_ES.pdf?ua=1
- Church D, Elsayed S, Reid O, Winston B, Lindsay R. Burn wound infections. Clin Microbiol Rev 2006; 19: 403-34.
- Altoparlak U, Erol S, Akcay MN, Celebi F, Kadanali A. The time related changes of antimicrobial resistance patterns and predominant bacterial profiles of burn wounds and body flora of burned patients. Burns 2004; 30: 660-4.
- Hsueh PR, Teng LJ, Yang PC, Chen YC, Ho SW, Luh KT. Persistence of a multidrug-resistant Pseudomonas aeruginosa clone in an intensive care burn unit. J Clin Microbiol 1998; 36: 1347-5.
- Pirnay JP, De Vos D, Cochez C, Bilocq F, Pirson J, StruelensM, et al. Molecular epidemiology of Pseudomonas aeruginosa colonization in a burn unit: persistence of a multidrug-resistant clone and a silver sulfadiazine-resistant clone. J Clin Microbiol 2003; 41: 1192-202.
- Sulakvelidze A, Alavidze Z, Morris JG Jr. Bacteriophage therapy. Antimicrob Agents Chemother 2001; 45:649–59.
- Viertel TM, Ritter K, Horz H-P. Viruses versus bacteria-novel approaches to phage therapy as a tool against multidrug-resistant pathogens. J Antimicrob Chemother 2014; 69:2326–36.
- McVay CS, Velásquez M, Fralick JA. Phage therapy of Pseudomonas aeruginosa infection in a mouse burn wound model. AntimicrobAgentsChemother 2007; 51: 1934-8.
- Kumari S, Harjai K, Chhibber S. Bacteriophage versus antimicrobial agents for the treatment of murine burn wound infection caused by Klebsiella pneumoniae J Med Microbiol 2011; 60: 205-10.
- Kumari S, Harjai K, Chhibber S. Efficacy of bacteriophage treatment in murine burn wound infection induced by Klebsiella pneumoniae. J Microbiol Biotechnol2009; 19(6): 622–628.
- Abul-Hassan HS, El-Tahan k Massoud B, Gomaa R. Bacteriophage therapy of Pseudomonas burn wound sepsis. Annals of the MBC 1990; 3: 262-6. Available from: http://www. medbc.com/annals/review/vol_3/num_4/te-xt/vol3n4p262.htm
- Soothill JS. Bacteriophage prevents destruction of skin grafts by Pseudomonas aeruginosa. Burns 1994; 20: 209-11.
- Weber-Dabrowska B, Mulczyk M, Górski A. Bacteriophage therapy of bacterial infections: an update of our institute’s experience. Arch Immunol Ther Exp (Warsz) 2000; 48: 547-51.
- Jikia D, Chkhaidze N, Imedashvili E, Mgaloblishvili I, Tsitlanadze G, Katsarava R, et al. The use of a novel biodegradable preparation capable of the sustained release of bacteriophages and ciprofloxacin, in the complex treatment of multidrug-resistant Staphylococcus aureus-infected local radiation injuries caused by exposure to Sr90. Clin Exp Dermatol 2005; 30: 23-6.
- Markoishvili K, Tsitlanadze G, Katsarava R, Morris JG Jr, Sulakvelidze A. A novel sustained-release matrix based on biodegradable poly(ester amide)s and impregnated with bacteriophages and an antibiotic shows promise in management of infected venous stasis ulcers and other poorly healing wounds. Int J Dermatol 2002; 41: 453-8.
- Marza JA, Soothill JS, Boydell P, Collyns TA. Multiplication of therapeutically administered bacteriophages in Pseudomonas aeruginosa infected patients. Burns 2006; 32: 644-6.
- Soothill J. Use of bacteriophages in the treatment of Pseudomonas aeruginosa Expert Rev Anti Infect Ther 2013; 11: 909-15.
- Marshall G, Blacklock JWS, Cameron C, Capon NB, Cruickshank R, Gaddum JH, et al. (1948). STREPTOMYCIN treatment of pulmonary tuberculosis. BMJ 2, 769–782.
- Spellberg B, Guidos R, Gilbert D, Bradley J, Boucher HW, Scheld WM, et al. Infectious Diseases Society of America (2008). The epidemic of antibiotic-resistant infections: a call to action for the medical community from the Infectious Diseases Society of America. Clin. Infect. Dis. 46, 155–164.
- Samson, I. (2005). A new class of antimycobacterial drugs: the diarylquinolines.Thorax 60, 495
- Ling LL, Schneider T, Peoples AJ, Spoering AL, Engels I, Conlon BP, et al. (2015).A new antibiotic kills pathogens without detectable resistance. Nature 517,455–459.
- Hover BM, Kim SH, Katz M, Charlop-Powers Z, Owen JG, Ternei MA, et al. (2018). Culture-independent discovery of the malacidins as calcium-dependent antibiotics withactivity against multidrug-resistant Gram-positive pathogens. Nat. Microbiol.3, 415–422.
- Fair RJ, and Tor Y. (2014). Antibiotics and bacterial resistance in the 21st Perspect. Medicin Chem. 6, 25–64.
- Heinz E, Ejaz H, Bartholdson-Scott J, Wang N, Guanjaran S, Pickard D, et al. (2018). Emergence of carbapenem, beta-lactamase inhibitor and cefoxitin resistant lineages from a background of ESBL-producing Klebsiella pneumoniae and K. quasipneumoniae highlights different evolutionary mechanisms. bioRxiv, 283291, https://doi.org/10.1101/283291.
- Global priority list of antibioticresistant bacteria to guide research, discovery, and development of new antibiotics. OMS. 2017;7.
- MinakshiG, Aman KN, Santosh KS, 2019. Bacteriological profile and antimicrobial resistance patterns of burn wound infections in a tertiary care hospital. 5,12.
- Aminov R, Caplin J, Chanishvili N, Coffey A, Cooper I, De Vos D, et al. Application of bacteriophages. Microbiol. Aust. 2018; 38: 63–66.
- Chanishvili, N. (2009).Phage Therapy—History fromTwort and d’Herelle Through Soviet Experience to Current Approaches. Advances in Virus Research, Volume 83, 1, 4-6.
- Kortright KE, Chan BK, Koff JL, and TurnerPE. Phage Therapy: A Renewed Approach to Combat Antibiotic-Resistant Bacteria. 2019.
- Aslanov BI, Zueva LP, Dolgiy AA, Lyubimova AV, Khoroshilov VY. Prospects for phagotherapy of hospital infections in the context of the formation of antibiotic resistance. Infektsiyaiimmunitet2012; 2(1–2): 471.
- Dodova EG, Gorbunova EA, Apolikhina IА. Post-antibiotic era: bacteriophages as a therapeutic strategy. Meditsinskiysovet2015; 11: 49–53.
- Esipov AV, Alekhnovich AV, Kislenko AM, Markevich PS, Zaitsev AE, Mishina LV. Bacteriophages under conditions of absorption of antibiotic resistance. Gospital’nayameditsina: naukaipraktika2018; 1(2): 39–42.
- Tapalsky DV, Kozlova AI. Sensitivity of Klebsiella pneumoniae clinical isolates with various levels of antibiotic resistance to bacteriophage preparations. Problemyzdorov’yaiekologii2018; 55(1): 56–62.
- Nazarov PA. Alternatives to antibiotics: phage lytic enzymes and phage therapy. Vestnik RGMU 2018; 1: 5–15.
- Golkar Z, Bagasra O, Jamil N. Experimental phage therapy on multiple drug resistant Pseudomonas aeruginosa infection in mice. J AntivirAntiretrovir2013; S10, https://doi. org/10.4172/jaa.s10-005.
- Holguín AV, Rangel G, Clavijo V, Prada C, Mantilla M, Gomez MC, et al.Phage ΦPan70, a putative temperate phage, controls Pseudomonas aeruginosa in planktonic, biofilm and burn mouse model assays. Viruses 2015; 7(8): 4602–4623,https://doi.org/10.3390/v7082835.
- Lazareva EB, Smirnov SV, Khvatov VB, Spiridonova TG, Bitkova EE, Darbeeva OS, et al. Efficacy of bacteriophage use in complex treatment of the patients with burn wounds. Antibiotikiikhimioterapiya2001; 46(1): 10–14.
- Międzybrodzki R, Borysowski J, Weber-Dąbrowska B, Fortuna W, Letkiewicz S, Szufnarowski K, et al. Clinical aspects of phage therapy. Adv Virus Res 2012; 83: 73–121, https://doi. org/10.1016/b978-0-12-394438-2.00003-7.
- Zimecki M, Artym J, Kocieba M, Weber-Dąbrowska B, Borysowski J, Górski A. Effects of prophylactic administration of bacteriophages to immunosuppressed mice infected with Staphylococcus aureus. BMC Microbiol 2009; 9: 169, https:// doi.org/10.1186/1471-2180-9-169.
- Przerwa A, Zimecki M. Switała-Jeleń K, Dabrowska K, Krawczyk E, Łuczak M, et al. Effects of bacteriophages on free radical production and phagocytic functions. Med Microbiol Immunol 2006; 195(3): 143–150, https://doi. org/10.1007/s00430-006-0011-4.
- Górski A., Jończyk-Matysiak E., Łusiak-Szelachowska M., Weber-Dąbrowska B., Międzybrodzki R., Borysowski J. Therapeutic potential of phages in autoimmune liver diseases. Clin Exp Immunol 2018; 192(1): 1–6, https://doi.org/10.1111/ cei.13092.
- Górski A., Jończyk-Matysiak E., Łusiak-Szelachowska M., Międzybrodzki R., Weber-Dąbrowska B., Borysowski J. Phage therapy in allergic disorders? Exp Biol Med (Maywood) 2018; 243(6): 534-537, https://doi.org/10.1177/1535370218755658.
- Górski A, Dąbrowska K, Międzybrodzki R, Weber- Dąbrowska B, Łusiak-Szelachowska M, Jończyk-Matysiak E, et al. Phages and immunomodulation. Future Microbiol 2017; 12: 905–914, https://doi.org/10.2217/fmb- 2017-0049.
- Górski A, Jończyk-Matysiak E, Łusiak-Szelachowska M, Międzybrodzki R, Weber-Dąbrowska B, Borysowski J. The potential of phage therapy in sepsis. Front Immunol 2017; 8: 1783, https://doi.org/10.3389/fimmu.2017.01783.
- Pires DP, Melo L, Vilas Boas D, Sillankorva S, Azeredo J. Phage therapy as an alternative or complementary strategy to prevent and control biofilm-related infections. CurrOpin Microbiol 2017; 39: 48–56, https://doi.org/10.1016/j.mib. 2017.09.004.
- Sarhan WA, Azzazy HM. Apitherapeutics and phage-loaded nanofibers as wound dressings with enhanced wound healing and antibacterial activity. Nanomedicine (Lond) 2017; 12(17): 2055–2067, https://doi.org/10.2217/nnm- 2017-0151.
- Gündoğdu A, Kılıç H, UluKılıç A, Kutateladze M. Susceptibilities of multidrug-resistant pathogens responsible for complicated skin and soft tissue infections to standard bacteriophage cocktails. MikrobiyolBul2016; 50(2): 215–223, https://doi.org/10.5578/mb.24165.
- Gorski A, Nowaczyk M, Weber-Dabrowska B, Kniotek M, Boratynski J, Ahmed A, et al. New insights into the possible role of bacteriophages in transplantation. Transplant Proс2003; 35(6): 2372–2373, https://doi.org/10.1016/s0041- 1345(03)00811-x.
- Kutateladze M, Adamia R. Bacteriophages as potential new therapeutics to replace or supplement antibiotics. Trends Biotechnol2010; 28(12): 591–595, https://doi.org/10.1016/j. tibtech.2010.08.001.
- Jault P, Leclerc T, Jennes S, Pirnay JP, Que YA, Resch G, et al. Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. Lancet Infect Dis 2019; 19(1): 35–45, https://doi.org/10.1016/s1473-3099(18)30482-1.
- Kutter E, De Vos D, Gvasalia G, et al. Phage therapy in clinical practice: treatment of human infections. Curr Pharm Biotechnol2010; 11: 69–86.
- Sulakvelidze A, Alavidze Z, Morris JG Jr. Bacteriophage therapy. Antimicrob Agents Chemother 2001; 45: 649–59.
- Chan BK, Abedon ST, Loc-Carrillo C. Phage cocktails and the future of phage therapy. Future Microbiol 2013; 8: 769–83.
- Nguyen S, Baker K, Padman BS, et al. Bacteriophage transcytosis provides a mechanism to cross epithelial cell layers. MBio 2017;8: e01874–17.
- Van Belleghem JD, Clement F, Merabishvili M, Lavigne R,Vaneechoutte M. Pro- and anti-inflammatory responses of peripheral blood mononuclear cells induced by Staphylococcus aureus and Pseudomonas aeruginosa phages. Sci Rep 2017; 7: 8004.
- Debarbieux L, Pirnay JP, Verbeken G, et al. A bacteriophage journey at the European Medicines Agency. FEMS Microbiol Lett 2016;363: fnv225.
- Jennes S, Merabishvili M, Soentjens P, et al. Use of bacteriophages in the treatment of colistin-only-sensitive Pseudomonas aeruginosa septicaemia in a patient with acute kidney injury—a case report Crit Care 2017; 21: 129.
- Brown J. Phage Therapy for the Prevention and Treatment of Wound Infections in Burned Patients. https://clinicaltrials.gov/ct2/show/NCT04323475

