 Impact of Severe Burns on Pancreatic Islets in a Murine Model
Impact of Severe Burns on Pancreatic Islets in a Murine Model
Santiago J. Santelis1, Ayse Ebru Abali 1,2, Gonca Ozgun 3, B. Handan Ozdemir 3, Neslihan Basci Tutuncu 4, Mehmet Haberal 1,2
1Unidad de Quemados, 2Departamento de Cirugía General, 3Departamento de Patología, y el 4Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Universidad de Baskent, Ankara, Turquía.
Dirigir correspondencia a: Santiago J. Santelis, Unidad de Quemados, Facultad de Medicina, Universidad de Baskent, Taşkent Cad. No:77, 06490 Bahçelievler, Ankara, Turkey
Teléfono: +14079235648 e-mail: sjsantelis@gmail.com
Conflicto de Intereses: los autores declaran no tener conflicto de intereses.
RESUMEN
Introducción: Los pacientes víctimas de quemaduras graves experimentan una respuesta inflamatoria sistémica y respuesta hipermetabólica muy marcada que genera efectos adversos en muchos órganos y sistemas distantes al área lesionada.
Objetivos: Describir los cambios histopatológicos generados por quemaduras graves en el páncreas de un modelo murino.
Materiales y Métodos: Un total de 14 ratas Wistar albinas fueron divididas en 2 grupos: grupo sham y grupo experimental. Al grupo experimental se le indujo una quemadura tipo B(espesor total) a nivel dorsal, abarcando25% de la superficie corporal total. Una semana después de generada la lesión, cada animal fue pancreatectomizado. El tejido pancreático fue examinado bajo microscopía de luz, y posteriormente se calcularon el tamaño y la celularidad de los islotes.
Resultados: Los hallazgos histopatológicos no fueron significativos, sin embargo, el número de islotes por tejido pancreático fue menor en el grupo experimental. De igual manera, se observó una diferencia estadísticamente significativa en el promedio de células por islote entre los 2 grupos, con un contaje celular elevado en el grupo experimental (P<.05).
Conclusiones: Durante la fase aguda de las quemaduras en el modelo experimental se observó una disminución del número de islotes pancreáticos con una marcada hipercelularidad. Se requieren futuros estudios para determinar las bases histológicas y celulares de estos cambios.
Palabras clave: Células beta. Hiperglicemia. Hipermetabolismo. Páncreas. Quemaduras graves.
ABSTRACT
Introduction: Severe burn victims experience a systemic inflammatory response and a hypermetabolic response that can generate adverse effects on many distant organs and systems.
Objectives: Our aim in this study was to describe the histopathological changes in the pancreatic islets secondary to severe burns in an experimental murine model.
Materials & Methods: Fourteen Wistar albino rats were randomly divided into 2 groups: the sham group and the burn group. A full-thickness burn model was designed to induce a burn of 25% total body surface area. Seven days after burn induction and sham procedure, pancreatectomy was performed. Pancreatic tissues were examined under light microscopy, and islet size and cellularity were calculated.
Results: The histopathologic examination was unremarkable, but the mean number of islets per pancreatic tissue was lower in the burn group than in the sham group. We observed a significant difference in the mean number of cells per one islet between the 2 groups, with the cell count higher in the burn group (P < .05).
Conclusions: During the acute phase of burn injury in rats, we observed a decrease in the number of pancreatic islets with remarkable hypercellularity. Further studies are needed to determine the histological and cellular basis of these changes.
Key words: Beta cells. Hyperglycemia. Hypermetabolism. Major burn. Pancreas. Severe burns.
INTRODUCCIÓN
Las quemaduras graves desencadenan una respuesta inflamatoria sistémica y una respuesta hipermetabólica que puede generar efectos adversos en muchos órganos distantes de las áreas quemadas. Estas respuestas fisiopatológicas se caracterizan por hipermetabolismo, inflamación e hipersecreción de catecolaminas, glucagón y cortisol y a su vez, todos estos cambios generan hiperglucemia(1,2). La hiperglucemia conduce a alteraciones locales y sistémicas transitorias o permanentes que pueden afectar las funciones endocrinas y exocrinas del páncreas. Estudios previos han identificado células beta atípicas y apoptóticas después de una lesión térmica severa(3,4).
Los efectos deletéreos de hiperglicemia aguda y prolongada incluyen: cicatrización deficiente, aumento del riesgo de pérdida de injertos, incremento del catabolismo de proteínas musculares, aumento en la incidencia de infecciones, e incluso la hiperglicemia está asociada con un aumento en el riesgo de muerte(5-10).Cabe destacar que las alteraciones en el metabolismo de la glucosa y la señalización de la insulina observadas durante el período post quemadura son similares a los observados en pacientes con diabetes mellitus tipo 2(11).
La presencia de hiperglucemia con hiperinsulinismo es indicativa de secreción insuficiente de insulina por parte de las células beta pancreáticas. Sin embargo, los mecanismos moleculares que generan esta falla no se conocen claramente(12). Las células acinares, son el tipo de célula más abundante en el páncreas y pueden desempeñar un papel crucial en esta respuesta, ya que se ha demostrado el mecanismo por el cual estas células pueden perder o cambiar su identidad bajo estrés metabólico. Aunque esta respuesta podría ser parcialmente reversible tan solo logrando un control glucémico adecuado(13), aún no se ha esclarecido el impacto de las quemaduras graves en este proceso.
Por todo lo antes expuesto, se planteó la hipótesis de que el stress generado por quemaduras graves podría desencadenar una condición similar a la diabetes mellitus tipo 2 en pacientes sin antecedentes personales de hiperglucemia. El propósito del presente trabajo fue describir los cambios macroscópicos y microscópicos agudos de los islotes pancreáticos en respuesta a quemaduras graves.
MATERIALES Y MÉTODOS
Un total de 14 ratas machos Wistar albinas con un peso entre 350 y 400 g fueron obtenidas del Centro de Cría de Animales del Laboratorio de la Universidad de Baskent en Ankara, Turquía. Todos los animales recibieron cuidados humanitarios que siguieron las pautas de la Guía para el Cuidado y Uso de Animales de Laboratorio del Instituto Nacional de Salud (NIH, por sus siglas en ingles). Las ratas se mantuvieron en el Centro de Animales de Laboratorio de la Universidad de Baskent bajo condiciones estandarizadas de luz y temperatura. Todos los animales fueron alimentados con alimento estándar para ratas y tuvieron libre acceso al agua. El estudio fue aprobado por el Comité de Ética y Cuidado Animal de la Universidad de Baskent según resolución DA/2022/10.
Grupos
Los animales se dividieron aleatoriamente en 2 grupos de 7 ratas cada uno: el grupo simulado (grupo S) y el grupo experimental (grupo B). Todos los animales fueron anestesiados antes de realizar los procedimientos.
En el grupo S, se constató que las 7 ratas albinas Wistar estuviesen sanas, y fueron alimentadas con comida estándar para ratas y agua ad libitum una semana antes de que comenzaran los procedimientos de simulación. Se rasuró el dorso, se procedió a demarcar un área en dicha región y se administró anestesia intraperitoneal a cada animal. Tras aplicar una placa de bronce a temperatura ambiente en la región demarcada se aplicó solución de Ringer lactato (2 ml/100 g) vía intraperitoneal. Posteriormente, se administró clorhidrato de fentanilo y se colocaron apósitos limpios y secos para cubrir el área demarcada. Se continuó con la misma dieta estándar en condiciones de laboratorio durante los días posteriores, y al séptimo día se realizó pancreatectomía y los animales fueron sacrificados.
Los animales del grupo B fueron alimentados con alimento estándar para ratas y agua ad libitum la semana antes de que se indujeran las lesiones por quemaduras. Antes de la inducción de la lesión, se administró anestesia y se afeitó el dorso de cada animal. Las ratas recibieron una quemadura del 25 % del área de superficie corporal total siguiendo un método descrito previamente(14,15). La reanimación se logró mediante una inyección intraperitoneal de solución de Ringer lactato (2 ml/100 g) y se inyectó fentanilo para la analgesia posterior al procedimiento. Los animales fueron alimentados con el mismo protocolo nutricional (comida estándar para ratas) hasta el final del período experimental. Siete días después de infligir la quemadura, se tomó muestra de biopsia de la piel afectada, se realizaron pancreatectomías y se sacrificó a los animales.
Anestesia y analgesia
Para sedación y anestesia, el día del procedimiento se procedió a preparar una combinación de ketamina más xilazina que se administró vía intraperitoneal a cada animal a dosis de 100 mg/kg de clorhidrato de ketamina (Alfamine 10 %; AlfasanInc) y 10 mg/kg de clorhidrato de xilazina (Rompun 2 %, Bayer Kimya). Se utilizó clorhidrato de fentanilo a dosis de 0,02 mg/kg) para la analgesia posterior al procedimiento.
Modelo Experimental de Quemadura
Se diseñó un modelo experimental para inducir quemaduras tipo Breproducibles basado en nuestro modelo anterior. Tras rasurar y demarcar la región dorsal de los animales, se procedió a calentar bajo la llama de un mechero Bunsen una placa de latón cuyas medidas son de 4 cm × 4 cm. Para monitorizar la temperatura de calentamiento se utilizóun sensor termopar de un multímetro (Fluke 116 HVAC). Para crear una quemadura de espesor completo, la placa se calentó a una temperatura oscilando entre 255 °C y 260 °C (la placa pierde entre 5-10 °C antes de aplicarse a la piel) y se colocó sobre las áreas marcadas durante 10 segundos. Todos los animales fueron resucitados inmediatamente con solución de Ringer lactato (2 ml/100 g) vía intraperitoneal. Se aplicó sulfadiazina de plata (Silverdin) en el área afectada y se cubrió con apósitos estériles. Los animales fueron devueltos a las jaulas donde recuperaron actividad refleja y movilidad espontánea. El grosor de cada lesión se confirmó mediante examen histopatológico.
Pancreatectomía
Siete días después de los procedimientos simulados y de inducción de quemadura, se rasuró el área abdominal de cada animal, y previa asepsia y antisepsia se administró la mezcla anestésica previamente descrita vía intraperitoneal. Posteriormente, se realizó una incisión en la línea media del abdomen y se accedió a la cavidad peritoneal. Se identifico y exteriorizó gentilmente el ciego, se elevó el estómago tomándolo por la región pilórica y se expusieron el bazo y el páncreas. La disección se realizó en sentido cefálico y en dirección al bazo. Finalmente, se procedió a disecar el páncreas separándolo gentilmente del bazo y el duodeno con extrema precaución para evitar las estructuras circundantes, especialmente las vasculares (Figura 1).
Toma de muestras y fijación de tejido
Todos los especímenes de tejido pancreático se fijaron en formaldehido al 10 %. Se tomaron muestras de tal manera que sus ejes largos pudieran verse después de 24 horas de fijación, y luego fueron embebidas en bloques de parafina. Secciones de 4 µm de espesor de cada bloque se tiñeron con hematoxilina-eosina (H&E) y fueron examinadas bajo microscopía óptica. Posteriormente, las láminas se escanearon con el escáner 3DHistech Panoramic P250 Flash III.
Adquisición y análisis de imágenes
Los procesos de adquisición y análisis de imágenes se realizaron utilizando la aplicación ViraPath (Virasoft Software Inc). Después de capturar las imágenes, se marcaron los islotes pancreáticos. La aplicación calculó el tamaño de cada islote y el número de células dentro del mismo.
Análisis estadístico
El análisis estadístico se realizóutilizando el software SPSS (StatisticalPackageforthe Social Sciences, versión 25.0, SSPS Inc). Los resultados de las variables cuantitativas, las áreas calculadas de tejido pancreático, los islotes y el número de islotes y las células de los islotes se presentan como medias ± SD. Para las distribuciones normales se aplicó el análisis de varianza de una vía y la corrección de Bonferroni. Se consideró estadísticamente significativa una p < 0,05.
RESULTADOS
Uno de los animales del grupo experimental murió el tercer día postquemadura, y aunque los hallazgos macroscópicos en la autopsia no fueron significativos, se observó una disminución severa del número de islotes pancreáticos probablemente debido a cambios postmortem. En los animales restantes no se evidenciaron signos de infección local (en el sitio de la quemadura) y/o sistémica.
Hallazgos Macroscópicos
Los hallazgos intraoperatorios durante las laparotomías fueron casi similares en ambos grupos de estudio. Las diferencias más resaltantes se observaron en el grupo experimental, en el cual se evidenció hepatomegalia leve, tejido pancreático frágil y edematoso, y fragilidad vascular de las estructuras circundantes durante la disección del duodeno.
Hallazgos Microscópicos
A la microscopía óptica, no se observaron cambios significativos a nivel del tejido pancreático analizado en ambos grupos. (Figura 2).

Morfometría de los Islotes Pancreáticos
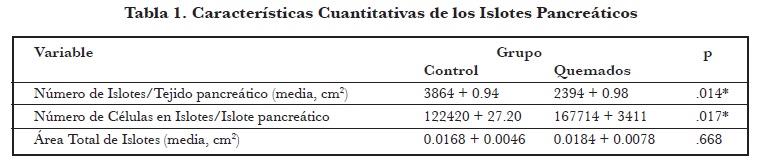
En el grupo experimental se observó una disminución más marcada del promedio de islotes por tejido pancreático. Se encontró también una diferencia estadísticamente significativa en el promedio de células por cada islote siendo el conteo celular más alto en el grupo experimental (P<.05). Sin embargo, no se encontraron diferencias significativas entre ambos grupos al calcular el tamaño promedio de cada islote (P > .05) (Tabla 1).
DISCUSIÓN
La quemaduras graves y críticas causan profundas alteraciones en la masa de células beta destinadas a mantener el nivel glucémico dentro de un rango fisiológico muy estrecho(16,17). Nuestro modelo experimental de quemadura puede ser aplicable a futuros estudios centrados en el impacto de las lesiones por quemaduras en la morfofisiología del páncreas.
Estudios recientes han identificado a través de microscopía óptica daño severo en la morfología pancreática de ratas con quemadas graves (3,4,18), lo cual podría sugerir la activación de mecanismos adaptativos en respuesta a la enfermedad por quemadura.
En el presente estudio, encontramos cambios morfológicos significativos en los islotes pancreáticos durante la fase aguda de la quemadura. El hallazgo más sorprendente fue la disminución del número total de islotes con una hipercelularidad marcada en los islotes restantes. Ha sido bien descrito, como las quemaduras graves y críticas inducen una profunda respuesta de estrés. La descarga hiperadrenérgica aguda desencadenada por las quemaduras, produce vasoconstricción esplácnica, lo cual a su vez puede causar hipoxia pancreática con la consecuente afectación de los islotes. Por lo tanto, la disminución en el número de islotes en las ratas 1 semana después de inducida la quemadura puede deberse a isquemia celular como consecuencia de hipoxia tisular secundaria a hipovolemia.
Además de los hallazgos previamente descritos, no se evidenció diferencia en el volumen total de los islotes, pero en los islotes residuales del grupo experimentalse observó una hipercelularidad marcada en comparación con el grupo sham. Una de las limitaciones de nuestro estudio fue que no se pudoidentificarel tipo de células proliferantes en los islotes, pero es muy probable que seanprincipalmente células beta, ya que éstas constituyen las células más activas en los islotes durante los cambios metabólicos postraumáticos. Es muy posible que dicha hipercelularidad sea también responsable del aumentodel volumen total observado en los islotes del grupo experimental, y como consecuencia del acortamiento dela brecha del volumen de los islotes observadosen ambos grupos. Otra explicación a este hallazgo podría ser que pese a la disminución del número de islotes en el grupo experimental, se produjo unaumento del volumen extracelular de los islotes restantes como consecuencia de la respuesta hiperadrenérgica o debido a isquemia.
Con respecto a los hallazgos macroscópicos observados (edema y fragilidad de las estructuras vasculares), es muy probable que se deban a la carencia de sistema linfático a nivel de la vasculatura, lo cual hace que estas estructuras sean más frágiles y propensas al edema especialmente durante condiciones de estrés fisiológico (16). Sin embargo, se requieren más estudios para determinar la base histológica y celular de estos cambios.
CONCLUSIONES
Desafortunadamente, la hiperglucemia y las complicaciones relacionadas a ella siguen siendo uno de los problemas endocrinológicos más desafiantes en el contexto de la respuesta al estrés metabólico postraumático. La hiperglucemia posquemadura ha sido identificada como un factor de riesgo independiente que puede causar un aumento a la susceptibilidad a infecciones graves, inducir falla multiorgánica, e incluso muerte en pacientes críticos. Por lo tanto, resulta de vital importancia dedicar esfuerzos a la comprensión, prevención, atenuación y control de los cambios pancreáticos transitorios y permanentes que ocurren como consecuencia de la enfermedad por quemaduras, especialmente bajo diferentes condiciones preexistentes e intervenciones terapéuticas (como la obesidad o los pacientes sometidos a regímenes dietéticos especiales que influyen en la regulación de los niveles de glucosa y la respuesta insulínica) que podrían servir de base y orientaciónterapéutica. Se necesitan más estudios no solo para mejorar las tasas de supervivencia, sino también para brindar mejor calidad de vida a esta población de pacientes bastante particular.
BIBLIOGRAFÍA
-
Sakallioglu AE, Basaran O, Karakayali H, et al. Interactions of systemic immune response and local wound healing in different burn depths: an experimental study on rats. J Burn Care Res. 2006;27(3):357-366. doi:10.1097/01.BCR.0000216330.93056.06.
-
Mizock BA. Alterations in fuel metabolism in critical illness: hyperglycaemia. Best Pract Res Clin Endocrinol Metab. 2001;15(4):533-551. doi:10.1053/beem.2001.0168.
-
Li DW, Shen CA, Chai JK, Ma L, Shang YR, Li LZ. [Structural and functional changes in islet beta cells in severely scalded rats]. Zhonghua Shao Shang Za Zhi. 2013;29(4):355-359.
-
Zhao DX, Ma L, Shen ZA, et al. [Influences of exendin-4 on the secretion function of islet beta cells from rats in the early stage of severe scald]. Zhonghua Shao Shang Za Zhi. 2016;32(12):752-758. doi:10.3760/cma.j.issn.1009-2587.2016.12.011
-
Mecott GA, Al-Mousawi AM, Gauglitz GG, Herndon DN, Jeschke MG. The role of hyperglycemia in burned patients: evidence-based studies. Shock. 2010;33(1):5-13. doi:10.1097/SHK.0b013e3181af0494.
-
Gauglitz GG, Herndon DN, Jeschke MG. Insulin resistance postburn: underlying mechanisms and current therapeutic strategies. J Burn Care Res. 2008;29(5):683-694. doi:10.1097/BCR.0b013e31818481ce.
-
McMurry JF Jr. Wound healing with diabetes mellitus. Better glucose control for better wound healing in diabetes. Surg Clin North Am. 1984;64(4):769-778. doi:10.1016/s0039-6109(16)43393-1.
-
Mowlavi A, Andrews K, Milner S, Herndon DN, Heggers JP. The effects of hyperglycemia on skin graft survival in the burn patient. Ann Plast Surg. 2000;45(6):629-632. doi:10.1097/00000637-200045060-00010.
-
Gore DC, Chinkes DL, Hart DW, Wolf SE, Herndon DN, Sanford AP. Hyperglycemia exacerbates muscle protein catabolism in burn-injured patients. Crit Care Med. 2002;30(11):2438-2442. doi:10.1097/00003246-200211000-00006.
-
Gore DC, Chinkes D, Heggers J, Herndon DN, Wolf SE, Desai M. Association of hyperglycemia with increased mortality after severe burn injury. J Trauma. 2001;51(3):540-544. doi:10.1097/00005373-200109000-00021.
-
Cree MG, Wolfe RR. Postburn trauma insulin resistance and fat metabolism. Am J Physiol Endocrinol Metab. 2008;294(1):E1-E9. doi:10.1152/ajpendo.00562.2007.
-
Nessa A, Rahman SA, Hussain K. Hyperinsulinemic hypoglycemia – the molecular mechanisms. Front Endocrinol (Lausanne). 2016;7:29. doi:10.3389/fendo.2016.00029.
-
Swisa A, Glaser B, Dor Y. Metabolic stress and compromised identity of pancreatic beta cells. Front Genet. 2017;8:21. doi:10.3389/fgene.2017.00021.
-
Abali AE, Cabioglu T, Ozdemir H, Haberal M. Interactive effects of acupuncture on pain and distress in major burns: an experiment with rats. Burns. 2015;41(4):833-842. doi:10.1016/j.burns.2014.10.028.
-
Abali AE, Karakayali H, Ozdemir BH, Bayraktar N, Abbas OL, Haberal M. Destructive pulmonary effects of smoke inhalation and simultaneous alterations in circulating IL-6, TNF-α, and IFN-γ levels at different burn depths: an experimental study on rats. J Burn Care Res. 2013;34(3):334-341. doi:10.1097/BCR.0b013e3182644e9b.
-
Cerf ME. Beta cell dysfunction and insulin resistance. Front Endocrinol (Lausanne). 2013;4:37. doi:10.3389/fendo.2013.00037.
-
Chen C, Cohrs CM, Stertmann J, Bozsak R, Speier S. Human beta cell mass and function in diabetes: recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 2017;6(9):943-957. doi:10.1016/j.molmet.2017.06.019.
-
Li D, Shang Y, Shen C, et al. Effects of exendin-4 on pancreatic islets function in treating hyperglycemia post severe scald injury in rats. J Trauma Acute Care Surg. 2018;85(6):1072-1080. doi:10.1097/TA.0000000000002066.

