 Understand Intercellular Communication in the wound healing process
Understand Intercellular Communication in the wound healing process
Autora: Lic. Zupancic Luciana
Enfermera
Enfermera titular en servicio de Guardia del Hospital Dr. Cosme Argerich. CABA
Instructora de prácticas profesionalizantes del Instituto Escuela de Enfermería Cruz Roja Argentina. Profesora de Farmacología para Enfermería.
Estudiante de carrera de posgrado de Cicatrización de Heridas de la Universidad Abierta Interamericana. Materia: Aspectos Bio Histo Fisio Patológicos de la cicatrización de Heridas
Director Dr. Cherjovsky Roberto
Prof. Dr. Genovese Jorge
Noviembre 2020
lucianazupancicg@gmail.com
Tel.:1133034799
Conflicto de intereses: Ninguno
Resumen
El objetivo de este trabajo es desarrollar y comprender los componentes principales de la piel y la señalización celular en el proceso de cicatrización por medio del análisis bibliográfico y la realización de mapas conceptuales para una presentación didáctica de la comunicación intercelular en general y en particular en la cicatrización de heridas. La importancia del conocimiento en la fisiología de la cicatrización repercute favorablemente en la curación de heridas.
Palabras clave: piel – señalización celular – cicatrización.
Abstract
The objective of this work is to develop and understand the main components of the skin and cell signaling in the healing process through bibliographic analysis and the realization of concept maps for a didactic presentation of intercellular communication in general and in particular in the wound healing. The importance of knowledge in the physiology of healing has a favorable impact on wound healing.
Key words: skin – cell signaling – healing.
Introducción
En los seres vivos, las células deben interpretar numerosas señales para poder coordinar sus comportamientos. En las plantas por ej., las células se comunican constantemente entre sí. Estas interacciones intercelulares permiten que una planta responda a las condiciones de luz, oscuridad y temperatura, que guían los ciclos de crecimiento, floración y producción de frutos.
La comunicación intercelular es la transferencia de información de una célula a otra. Las células se comunican entre sí mediante señales directas entre ellas o mediante la emisión de una sustancia recibida por la otra célula. Esta coordinación permite la homeostasis Una alteración en este proceso repercute en el equilibrio del restablecimiento tisular en caso de injuria del tegumento.
Estas moléculas mensajeras denominadas interleuquinas son proteínas sintetizadas por leucocitos, células endoteliales, del estroma del timo o de la médula ósea.
La complejidad del mismo requiere un análisis de cada etapa del proceso, conocer sus actores principales y lograr un acercamiento a la comunicación intercelular para comprender la fisiología en la cicatrización de heridas.
Por ello es imprescindible conocer este proceso, las células intervinientes e interferencias posibles en la cicatrización de heridas.
En este trabajo se desarrollarán los conceptos principales del proceso de señalización celular de la piel, su estructura y las etapas de cicatrización de heridas.
Desarrollo
- Principios generales de la señalización celular
Al igual que en la conversación humana la mayoría de las células animales envían y reciben señales y por lo tanto pueden actuar como células señalizadoras y cómo células receptoras. La transducción de la señal comienza cuándo la proteína receptora de una célula Diana recibe una señal extracelular y la convierte en señales intracelulares que modifican el comportamiento celular (1).
Las células de los organismos cuentan con centenares de moléculas extracelulares en el envío de señales: proteínas, péptidos, aminoácidos y nucleótidos esteroides derivados de ácidos grasos e incluso gases disueltos, pero sólo tienen unos pocos estilos básicos de comunicación que transmiten el mensaje.
En los organismos pluricelulares el estilo más conocido de comunicación consiste en transmitir la señal a todo el cuerpo secretando moléculas señalizadoras en el torrente sanguíneo. Las moléculas señalizadoras utilizadas de esta manera se denominan hormonas. En los animales las células que producen las hormonas en la misma célula se denominan células endocrinas.
En la comunicación endócrina las moléculas señalizadoras son secretadas al torrente sanguíneo por medio de hormonas. En la señalización paracrina, en lugar de ingresar en el torrente sanguíneo, las moléculas señalizadoras difunden en forma local a través del fluido extracelular y permanecen cerca de la célula que las secreta. Actúan como mediadores locales sobre las células cercanas.
Muchas de las moléculas señalizadoras que regulan la inflamación en el sitio de una infección o que controlan la proliferación celular en una herida en vías de cicatrización, actúan de esta manera. En algunos casos, las células pueden responder a mediadores locales que producen ellas mismas, llamadas autocrinas. La señalización neuronal al igual que las células endocrinas, puede enviar mensajes a largas distancias. En este caso, el mensaje se transmite de manera rápida y específica a células Diana (1).
Una cuarta forma de comunicación intercelular mediada por señales, no requiere la liberación de una molécula secretora, sino que entran en contacto físico directo a través de moléculas señalizadoras alojadas en la membrana plasmática celular y las moléculas receptoras incluidas en la membrana plasmática y las células Diana.
La proteína receptora realiza el primer paso de la transducción de señales: se le une la señal extracelular lo que genera como respuesta nuevas señales intracelulares. Por lo general, el proceso de señalización intracelular resultante actúa como una carrera de relevo molecular, el mensaje es pasado de una molécula a otra, hasta que se activa una enzima metabólica, el citoesqueleto adopta una nueva configuración, un gen es activado o desactivado como respuesta celular. Las proteínas de señalización intracelular pueden transmitir, amplificar, integrar y distribuir la señal que ingresa (1).
Entre los agentes responsables de la comunicación intercelular se encuentran proteínas y glucoproteínas denominadas citocinas producidas por linfocitos y macrófagos activados, polimorfonucleares, células endoteliales, epiteliales, adipocitos, miocitos y del tejido conjuntivo. Inducen la activación, proliferación y diferenciación celular, actúan fundamentalmente como reguladoras de las respuestas inmunitaria e inflamatoria.
La desactivación de las vías de señalización es tan importante como su activación, cada componente activado de una vía de señalización debe ser desactivado para que la vía vuelva a funcionar.
Las distintas vías de señalización intracelular interactúan, lo que permite que las células produzcan una respuesta apropiada a una compleja combinación de señales. Algunas combinaciones de señales permiten que sobreviva, otras inducen proliferación celular y en ausencia de señales pueden sufrir apoptosis.
La función del sistema inmunológico depende en gran parte de las interleucinas. Su principal papel es regular los eventos que atañen a las funciones de estas poblaciones de células del sistema inmunitario, como la activación, diferenciación o proliferación de anticuerpos.
Las principales citoquinas que actúan en la respuesta inespecífica o inflamación son: Interleucina 1 (IL-1) producida por macrófagos, y células epiteliales, induce reacción de fase aguda y la activación y reconocimiento por parte de linfocitos T y macrófagos del lugar donde se desarrolla la respuesta inmunitaria, actúa junto con el Factor de Necrosis Tumoral (TNF) en la inmunidad innata y la inflamación. Interleucina Il-6 segregada por macrófagos, participa en reacciones de fase aguda, también estimula el crecimiento y diferenciación tanto de linfocitos T como linfocitos B. En inflamación los macrófagos son estimulados para producir múltiples moléculas tales como óxido nítrico (NO), chemocinas, leucotrienos, prostaglandinas, factor activador de plaquetas.
Estas moléculas forman la respuesta inflamatoria, caracterizada por permeabilidad vascular aumentada y reclutamiento de células inflamatorias. Fuera de efectos locales las monocinas tienen efectos sistémicos que contribuyen a las defensas del huésped tales como: inducción de fiebre y proteínas de respuesta aguda inflamatoria como la proteína C Reactiva (2).
2. Estructura y componentes principales de la piel El tejido es un conjunto de células similares que desempeñan una función, los principales tejidos del cuerpo humano son: el tejido epitelial, el conjuntivo, muscular y el tejido nervioso. Aparecen en el período embrionario las tres capas germinales primitivas: endodermo, mesodermo y ectodermo. Este proceso se denomina gastrulación y el proceso de diferenciación de las capas germinales primitivas en los distintos tipos de tejido se denomina histogénesis.
Figura 1: Componentes del Sistema tegumentario.
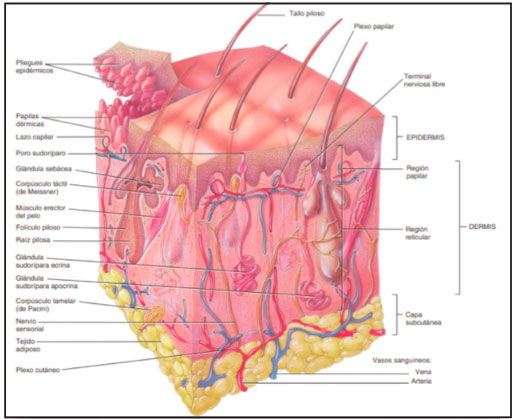
Fuente: Tortora; Derrickson. Principios de anatomía y fisiología. 13ª Ed. Panamericana 2011.186
El ectodermo es la capa más extensa. Es el origen del sistema nervioso, las vías respiratorias altas, el tubo digestivo, la epidermis y sus anexos.
El tejido epitelial se subdivide en dos tipos: membranoso o de recubrimiento y el glandular. Las funciones son de protección, sensitivas de secreción, absorción y excreción.
La piel o membrana cutánea, es el órgano que reviste nuestro cuerpo, forma parte del sistema tegumentario constituido por la piel, el pelo, las uñas y las glándulas subcutáneas. Brinda protección de barrera con el medio externo, minimizando las pérdidas hídricas y de temperatura, protegiéndonos de la radiación ultravioleta y agentes infecciosos.
La piel es el órgano más grande ocupa entre 1,6 y 2 m², en el caso del adulto y su espesor varía entre los 0,5 mm (en los párpados) a los 4 mm (en el talón). Su peso aproximado es de 5 kg, 1/6 de la masa corporal aproximadamente (3).
Conformada por tres capas: una exterior, llamada epidermis, otra más gruesa, denominada dermis y la hipodermis o tejido subcutáneo. La dermis es una capa de tejido conjuntivo relativamente denso y vascular. La zona donde las células de la epidermis se unen con las células del tejido conjuntivo de la dermis se denomina unión dermoepidérmica. Debajo de la dermis se encuentra una capa subcutánea, laxa, rica en grasa y en tejido areolar: la hipodermis o aponeurosis superficial (4).
2.1 Epidermis
La epidermis es un epitelio plano avascular en constante proceso de renovación, compuesta por cinco capas celulares diferentes. La división celular tiene lugar en la capa celular inferior, esto es imprescindible para el constante crecimiento y regeneración de la epidermis (5).
La función más importante de la piel, la protección, depende en gran medida de las características estructurales especiales de la epidermis y de su capacidad para crearse y auto repararse tras la lesión o enfermedad. A medida que se pierden las células de la superficie del estrato córneo, ha de producirse la sustitución de estas por actividad mitótica. Para mantener constante el espesor de la epidermis, deben formarse nuevas células al mismo ritmo que se descaman las viejas células queratinizadas del estrato más superficial, llamado sustrato córneo. Las células progresan hacia arriba desde el estrato basal a cada capa sucesiva, son queratinizadas y finalmente se descaman (se desprenden), como hicieron sus predecesoras. Dependiendo de las condiciones fisiológicas la renovación de la epidermis abarca un periodo aproximado de 30 días (6).
Se compone en un 98% de queratinocitos que son las células epiteliales principales. Se denominan así porque son capaces de sintetizar una proteína fibrosa denominada queratina. Estas son proteínas estructurales insolubles y con gran resistencia a altas temperaturas y pH unidas por uniones intercelulares fuertes llamados desmosomas.
El 2% restante está compuesto por melanocitos que son los responsables de dar el color a la piel y dos tipos celulares que tienen funciones inmunológicas que son las células de Langerhans y las de Merckel (7). Podemos dividir la epidermis en tres capas siguiendo un concepto dinámico de vida celular:
La capa reproductiva que corresponde a la primera semana de vida celular, es la más profunda, y es durante ese período en que el queratinocito tiene capacidad de reproducción.
La capa secretora con queratinocitos que perdieron su capacidad de reproducción, pero tienen gran capacidad secretora por dos semanas.
La capa más superficial es la llamada capa de muerte celular o de queratinización y se caracteriza por tener células muy maduras que ya no secretan y que están muriendo, pero rodeada de grandes cantidades de queratina y ceramida que hacen que la piel sea impermeable y que sirva como barrera contra agentes patógenos.
En el transcurso de su evolución a través de las diferentes capas epidérmicas (basal, espinosa, granulosa y córnea), el queratinocito sigue un programa de diferenciación terminal. Los distintos genes que codifican proteínas estructurales (queratinas o elementos de unión) y reguladoras (enzimas), se van activando y desactivando, contribuyendo a la arquitectura de las células, cada vez más aplanadas y con contenido más denso. Estas células están llenas de una sustancia, tipo gel blando, denominada eleidina, que finalmente se transformará en queratina. La eleidina es rica en lípidos unidos a las proteínas y sirve para bloquear la penetración o la pérdida de agua. Es evidente en cortes de la piel gruesa de las plantas de los pies o de las palmas de las manos.
A partir de la interface entre la granulosa y la capa córnea, se detiene la síntesis de proteínas y se sintetizan los cuerpos lamelares, que liberan al espacio extracelular diferentes fracciones lipídicas que se organizarán en el estrato córneo (8).
2.2 Dermis
En la dermis abundan las fibras de colágeno y fibras elásticas. Se divide en una capa papilar y una capa reticular. Conformada por folículos pilosos, músculo pilo erector, terminaciones nerviosas aferentes, glándulas sebáceas, glándulas sudoríparas, vasos sanguíneos y linfáticos.
Debido a su rica vascularización juega un papel importante termorregulador, y la red nerviosa formada en su interior actúa procesando información sensitiva referente al dolor, presión, tacto y temperatura. En ella se encuentran los anexos cutáneos, que son de dos tipos: córneos (pelos y uñas) y glandulares (glándulas sebáceas y sudoríparas).
Capa o estrato papilar
Esta capa es la más externa, se encuentra unida a la epidermis por pequeñas protuberancias cónicas de tejido conjuntivo laxo conteniendo fibras elásticas. Presenta elevaciones en forma de dedos, que se proyectan en el interior de la epidermis llamadas papilas. Formadas esencialmente por elementos de tejido conjuntivo laxo y una fina red de delicadas fibras colágenas y elásticas.
En estas papilas se encuentran las asas capilares que aseguran el abastecimiento nutritivo de la epidermis avascular, así como receptores nerviosos sensitivos y vasos linfáticos iniciales. La fina capa epidérmica de la piel se adapta estrechamente a las crestas de las papilas dérmicas. En consecuencia, la epidermis tiene también en su superficie unas crestas características, especialmente bien definidas en la punta de los dedos de manos y pies. Su patrón es único para cada uno de nosotros, son las huellas dactilares. Estas crestas desempeñan la función de asirnos a las superficies con firmeza y agarrar y utilizar las herramientas. Tiene unos receptores del tacto llamados corpúsculos de Meissner y terminaciones nerviosas libres, que detectan el dolor y la temperatura.
Capa o estrato reticular
La gruesa capa reticular de la dermis consta de una retícula o red de fibras mucho más densa que se observa en la capa papilar sobre ella. Se trata de una densa capa de fibras colágenas blancas, fuertes y entrelazadas. Consiste en tejido conjuntivo denso irregular conteniendo fibras de colágeno tipo I. Aunque la mayoría de sus fibras son de tipo colágeno, lo que confiere resistencia a la piel, también hay fibras elásticas que hacen a la piel distensible y elástica, permite adaptarse a los diferentes movimientos y cambios en el volumen corporal.
Las fibras colágenas se distribuyen a lo largo del cuerpo de una forma determinada según la región corporal, debido a las líneas naturales de tensión cutánea, en ello están basadas las líneas de tensión cutánea de Langer. Forman las líneas de incisión o tensión en la piel que indican la dirección predominante de las fibras de colágeno subyacentes. Estas líneas son especialmente evidentes en las superficies palmares de los dedos en donde se colocan paralelas al eje longitudinal de los dedos y son de interés en el proceso de cicatrización. Una incisión paralela a las fibras de colágeno curará con una fina cicatriz, mientras que una incisión que cruce las fibras, desorganiza el colágeno por lo cual las heridas pueden quedar abiertas y con cicatriz gruesa y ancha.
La capacidad de la piel para estirarse puede verse en el embarazo, la obesidad y el edema. Los desgarros pequeños que ocurren en las fibras de la dermis durante un estiramiento extremado, son inicialmente rojos y después permanecen visibles como estrías blanquecinas.
Las fibras nerviosas terminan en abultamientos denominados corpúsculos:
Corpúsculos de Paccini, registro de vibraciones y presión, se encuentran principalmente en manos y pies. Corpúsculos de Ruffini, captan deformaciones y el calor. Corpúsculos de Meisner en distales digitales, detectan formas, textura y corpúsculos de Krause especializados en la sensación del frío.
La capa reticular permanece unida a los órganos subyacentes, por la capa subcutánea o hipodermis.
Las células de la dermis comprenden los fibroblastos, macrófagos, mastocitos, linfocitos, células plasmáticas, eosinófilos y monocitos (7).
Los fibroblastos son los responsables de la producción de todos los componentes de la matriz extracelular. En caso de estimulación, como sucede en la cicatrización de una herida, los fibroblastos se dividen y sintetizan componentes extracelulares de un modo activo, aumentando de tamaño, sintetizan y liberan los precursores del colágeno, elastina y proteoglucanos para construir la matriz extracelular. Secretan colágeno tipo I, proteínas de la matriz extracelular,
proteoglicanos, ácido hialurónico, interleuquinas y factores de crecimiento (7).
Las células endoteliales, de origen mesenquimático, son responsables de la neovascularización o del proceso conocido como de angiogénesis. Tapizan el endotelio de capilares arteriales y venosos. Tienen gran importancia en la regulación de la permeabilidad capilar según se separen o cierren entre sí. Este mecanismo está regulado por sustancias como la elastasa, secretada por los neutrófilos polimorfonucleares. Estas células tienen gran capacidad de reproducción lo que permite la formación de nuevos capilares.
Los macrófagos, células de vida larga siempre presentes pero que aumentan en número en el proceso inflamatorio. Son los responsables de la secreción de sustancias pro inflamatorias como la interleuquina 1 y del factor de necrosis tumoral, ambos productores de fiebre (7).
El colágeno forma parte del esqueleto de la matriz extracelular. Se presenta en forma de fibras las cuales se forman una vez que han sido secretadas por el fibroblasto. El tipo I es el más importante en el tejido cicatrizal normal y el tipo III en el tejido cicatrizal hipertrófico.
La matriz extracelular o sustancia fundamental es el espacio libre entre los elementos celulares y fibrosos, es un fluido gelatinoso en el que las células se pueden mover libremente, una sustancia amorfa compuesta principalmente por proteínas glicosiladas: glucosaminoglicanos y proteoglicanos (heteropolisacáridos y proteínas), antiguamente denominados mucopolisacáridos, que debido a su gran capacidad de absorción de agua, forman una materia pegajosa y gelatinosa, que no sólo sirve como elemento de unión entre el resto de elementos tanto celulares como fibrosos, sino que influencia la migración, la cementación y la diferenciación celular. Son el Condroitin sulfato 4 y 6, el heparan sulfato, el dermatan sulfato y el más importante por su cantidad, el ácido hialurónico. Las funciones de este último son:
- Adherencia celular que facilita la formación de nuevos tejidos por la aparición de fibroblastos y células endoteliales.
- Sirve de sustrato para la reproducción de diferentes
líneas celulares.
- Sustrato para que en él puedan depositarse factores de crecimiento y fibronectina.
- Es un desactivador de proteasas tóxicas producidas por los neutrófilos.
Las fibras pertenecen a dos clases: fibras de colágeno y fibras elásticas.
Las fibras de colágeno están compuestas, a su vez, por moléculas alargadas de colágeno que son las proteínas fibrilares extracelulares más abundantes e importantes del organismo. Hay unos 20 tipos de cadenas polipeptídicas de colágeno, producidas por diferentes genes, que se combinan entre sí para producir los distintos tipos de colágeno. Los colágenos de tipo I, II y III se organizan como fibras. Las fibras de colágeno de tipo I suelen ordenarse en haces gruesos, lo que proporciona una gran fuerza. Las fibras de colágeno son flexibles, pero ofrecen una gran resistencia a una fuerza de tracción.
El colágeno es el que forma el 30% del esqueleto de la matriz extracelular. Se presenta en forma de fibras las cuales se forman una vez que han sido secretadas por el fibroblasto. El tipo I es el más importante en el tejido cicatrizal normal y el tipo III en el tejido cicatrizal hipertrófico.
Una enzima, la Hialuronidasa, puede hacer que la matriz pase de un estado de gel viscoso a una consistencia acuosa. Algunas bacterias, sobre todo los neumococos y estreptococos, pueden difundir por el tejido conjuntivo y segregar hialuronidasa.
Los factores de crecimiento, son polipéptidos de bajo peso molecular. Tienen la función de estimular la multiplicación celular actuando sobre el ADN de la célula efectora. Tienen propiedades de atraer células de estirpe blanca, células endoteliales, fibroblastos y queratinocitos.
- BFGF: factor de crecimiento de fibroblasto básico, producido por queratinocitos y fibroblastos, estimula el crecimiento de éstos mismos.
- EGF: factor de crecimiento epitelial, producido por queratinocitos, fibroblastos y células endoteliales, estimula el crecimiento de queratinocitos.
- PDGF: factor de crecimiento de plaquetas, producido por plaquetas y células endoteliales, estimula el crecimiento del queratinocito.
- TGF BETA: factor de crecimiento transformador, producido por fibroblastos y plaquetas, inhibe el crecimiento de queratinocitos, pero estimula motilidad.
Funciones:
- Proliferación celular de fibroblastos, células endoteliales y queratinocitos.
- Migración celular.
- Formación de capilares o angiogénesis.
- Estimulación de secreción de colágeno y de proteínas extracelulares por el fibroblasto y de queratina por el queratinocito.
Estos factores de crecimiento pueden no actuar si las proteasas producidas por neutrófilos y bacterias han ocupado el receptor de membrana de la célula efectora (14).
2.3 Hipodermis
- La hipodermis es la capa subcutánea de la piel, es la continuación en profundidad de la dermis. Es un estrato de la piel que está compuesto de tejido conjuntivo laxo y adiposo, de ahí las denominaciones de grasa subcutánea o panículo adiposo. Forma lobulillos separados por tabiques de tejido conectivo, continuación del conectivo de la dermis reticular y por donde discurren vasos y nervios lo cual le da funciones a la piel de regulación térmica y de movimiento. Sus fibras colágenas y elásticas se conectan directamente con las de la dermis y corren en todas direcciones, aunque principalmente en forma paralela a la superficie de la piel. El espesor de la hipodermis es muy variable dependiendo de la localización, el peso corporal, el sexo y la edad.
Los componentes propios que integran al tejido subcutáneo son: ligamentos cutáneos, nervios cutáneos, grasa, vasos sanguíneos y linfáticos.
Las células adiposas proceden de células mesenquimatosas indiferenciadas y están especializadas en la síntesis y almacenamiento de lípidos. La capa más externa llamada areolar, está en contacto con la dermis. La capa lamelar, es la más profunda, conformada por células fusiformes y se distribuyen horizontalmente; esta capa se incrementa cuando las personas ganan peso, se debe al aumento de volumen de los adipocitos capaces de invadir la capa más superficial de la piel.
Este tejido protege y sostiene diversos órganos y constituye una reserva de energía fundamental para el organismo ya que es responsable de modular el metabolismo energético y condicionar el metabolismo general en coordinación con diversas hormonas, mediante la secreción a la sangre de diversas proteínas, como la leptina.
Las principales funciones de la hipodermis son:
- Protección del organismo de posibles traumatismos
moderados y de otras agresiones externas.
- Termorreguladora de la temperatura corporal, proporciona forma a tu contorno corporal y le da movilidad a toda tu piel.
- Interviene en la síntesis de la vitamina D.
- En ella se encuentra el sistema linfático, que cumple una función importante en la defensa del organismo. Sus vasos articulados corren paralelos a los sanguíneos circulando la linfa entre la piel y los músculos (9).
- Proceso de cicatrización de heridas
El proceso de cicatrización de una herida es un conjunto de procesos dinámicos cuya secuencia se superpone en el tiempo.
El proceso se divide en las siguientes etapas: hemostasia, inflamación, angiogénesis, crecimiento y de remodelación tisular.
La fase inflamatoria se inicia producida la lesión del tejido, con la activación de los elementos formes de la sangre y a la formación del coágulo o tapón hemostático para lo cual interviene la cascada de coagulación y el fenómeno de agregación plaquetaria.
La vasodilatación y el aumento del flujo sanguíneo, causa permeabilidad vascular, edema y reclutamiento de leucocitos inflamatorios. Se secreta histamina, serotonina, proteasa y otros mediadores, lo que promueve una mayor permeabilidad microvascular de los vasos sanguíneos que rodean la herida. Además del enrojecimiento y calor. Facilitan la extravasación de fibrinógeno y otros factores derivados del plasma que sirven como quimios atrayentes para la entrada de células inflamatorias en la herida.
La hemostasia es la primera etapa de la cicatrización de heridas, detiene el sangrado después del daño vascular. Ocurre en tres pasos: vasoconstricción, hemostasia primaria y hemostasia secundaria. La hemostasia primaria implica la agregación plaquetaria y la formación de tapón plaquetario que se produce por la exposición del colágeno dentro de la matriz subendotelial (10).
En la hemostasia secundaria se produce la activación de la cascada de coagulación donde el fibrinógeno soluble se convierte en hebras insolubles que forman la malla fibrosa. El tapón de plaquetas y la malla fibrina se combinan para formar el trombo, que detiene el sangrado, libera complementos y factores de crecimiento, y proporciona un armazón provisional para infiltrar las células necesarias para la cicatrización de heridas.
Al producirse por la acción de la injuria la ruptura del queratinocito, la Actina que es la proteína que forma el esqueleto del queratinocito, se hace extracelular y atrae a la plaqueta. Esta llega dentro de los primeros segundos y libera de sus gránulos alfa, tromboxano A que activa la cascada de la coagulación y también libera PDGF, el factor de crecimiento derivado de plaquetas, que también actúa como quimiotáctico atrayendo a la segunda célula que es el polimorfonuclear.
El coágulo fibroso detiene el flujo sanguíneo y proporciona un andamiaje para las células inflamatorias entrantes. Los neutrófilos son reclutados inmediatamente como primera línea de defensa.
Antes de morir y eliminarse por el sistema reticuloendotelial, secretan otro factor de crecimiento TGF alfa, que actúa atrayendo a la tercera célula que son los monocitosmacrófagos. Estos secretan dos sustancias pro inflamatorias que producen fiebre, la interleukina 1 y el factor de necrosis tumoral alfa. Los monocitos se reclutan dentro de las 48 – 96 hs después de la lesión y se transforman en macrófagos activados por tejidos en el sitio de la herida. El sistema inmunitario adaptativo que comprende células de Langerhans, células dendríticas dérmicas y células T también se activan para combatir antígenos propios y extraños. En este proceso de inflamación aguda, se produce una respuesta inflamatoria aguda local, pero si la lesión es
extensa la respuesta inflamatoria se hace sistémica. Entonces en primer lugar, se produce la adhesión de las plaquetas al tejido intersticial dónde son activadas por la trombina generada localmente y el colágeno fibrilar expuesto. Como resultado de esta activación se produce la liberación de numerosos mediadores, tres de ellos son el fibrinógeno, fibronectina y trombospondina. Intervienen en la agregación plaquetaria, otros como el factor XIII y de Von Willebrand contribuyen a la adhesión plaquetaria actuando como puente de unión entre el colágeno subendotelial y el receptor plaquetario.
En forma simultánea las células endoteliales producen prostaciclina que inhibe la agregación limitando este proceso. Otras sustancias que intervienen son la antitrombina III, la proteína C y el activador del plasminógeno y la plasmina.
Las plaquetas son importantes también en la síntesis de factores de crecimiento necesarios para la curación de las heridas con acción mitógena y quimiotáctica en los fibroblastos y estimulan la reepitelización. La formación de un coágulo se produce por la cascada de coagulación que inician los elementos de la sangre por vías principales, la intrínseca y extrínseca. Ambas llevan a la formación de trombina, enzima que transforma el fibrinógeno en fibrina y causa la coagulación de la sangre.
El coágulo de fibrina no sólo produce hemostasia, sino que junto con la fibronectina proporciona una matriz provisional para la migración de monocitos, fibroblastos y queratinocitos. También aumenta la permeabilidad vascular, atrae neutrófilos, y monocitos al sitio de la herida, así se inicia la función de fagocitosis de bacterias y proteínas de la matriz por medio de la liberación de enzimas hidrolasas, proteasas y lisozimas y la producción de radicales libres de oxígeno. Finalmente, los neutrófilos agotados quedan atrapados en el coágulo y los que permanecen en tejido viable mueren por apoptosis y posteriormente son removidos por los macrófagos. Dos o tres días después de la lesión se produce el acúmulo de monocitos que reemplazan a los neutrófilos.
Los macrófagos se unen a las proteínas de la matriz extracelular mediante receptores de integrinas promoviendo la fagocitosis. De esta forma se produce la descontaminación del foco y el desbridamiento autolítico facilitado por la liberación de enzimas como las colagenasas. Los macrófagos son críticos para la curación normal de heridas y la regeneración de tejidos. Además de ser bactericidas, los macrófagos también realizan eferocitosis, que es fundamental para eliminar los neutrófilos gastados dentro de los 3 a 4 días posteriores a la lesión.
La falla en la activación de la eferocitosis de neutrófilos puede conducir a una necrosis secundaria donde los neutrófilos se lisan, lo que resulta en la liberación de moléculas proinflamatorias y citotóxicas y aumenta el daño tisular. La eliminación oportuna de los neutrófilos es crítica ya que la desaparición de los neutrófilos comienza la resolución de la inflamación. La persistencia de neutrófilos conduce a un estado inflamatorio prolongado (11).
Durante la fase proliferativa de la cicatrización de heridas, se forma simultáneamente tejido conectivo nuevo o tejido de granulación con otros procesos de curación, incluida la reepitelización, la neovascularización y la inmunomodulación. El tejido de granulación está formado principalmente por fibroblastos activados, que sintetizan una nueva matriz extra celular y ayudan a contraer la herida.
La angiogénesis implica la proliferación, migración y ramificación de las células endoteliales para formar nuevos vasos sanguíneos. Concurrente con proliferación de células endoteliales, se activan los pericitos dentro de la lámina basal que andamia y proporciona integridad estructural a las células endoteliales
Una vez que se produce la reepitelización, los miofibroblastos del tejido de granulación continúan sintetizando metaloproteinasas de matriz (MMP) y sus respectivos inhibidores tisulares de las metaloproteinasas (TIMP). Los MMP se dirigen a sus componentes específicos de la matriz extracelular para la degradación, un paso esencial para la remodelación. A medida que las MMP trabajan para reconstituir, los TIMP comienzan a bloquear, para regular la degradación de la matriz extracelular (MEC).
Un desequilibrio entre las MMP y las TIMP puede conducir a una cicatrización crónica (11).
Los fibroblastos van depositando una nueva matriz provisional de fibronectina y ácido hialurónico, son estimulados por citoquinas y factores de crecimiento para comenzar a sintetizar la matriz de colágeno tipo I, III y VI. Cesa la producción, con suficiente cantidad de depósito, inhibiéndose la proliferación de fibroblastos y la síntesis de colágeno.
En la reepitelización, los queratinocitos migran desde los bordes de la herida o desde los nexos remanentes con el fin de restablecer la barrera cutánea. La migración se produce por un cambio de fenotipo.
El colágeno neoformado se une a través de enlaces covalentes cruzados con haces del borde de la herida y con haces de la dermis adyacente. Se estimula la contracción de la herida con reducción del tamaño. La remodelación tisular es la última etapa, el fibroblasto produce fibronectina, ácido hialurónico, proteoglicanos y colágeno durante la fase de reparación sirviendo como base para la migración celular y soporte tisular. La fibronectina y el ácido hialurónico se van desprendiendo por acción de las enzimas proteasas y hialuronidasas.
Al cabo de un año o más el colágeno tipo III que se depositó durante la reparación es reemplazado por el tipo I con un fenotipo más estable y similar al que tenía la dermis originariamente (12).
Las heridas crónicas son aquellas que se han detenido en la fase inflamatoria debido a un desbalance entre los factores de crecimiento y las proteasas. Este desequilibrio se debe a la presencia exagerada de citoquinas proinflamatorias, disminución de los factores de crecimiento, alteración en el depósito de colágeno y de la matriz, alteración de la proliferación celular y de la síntesis proteica y aumento de la apoptosis.
Las metaloproteinasas tienen una acción distinta a la que tienen en las heridas agudas. En las heridas crónicas del exudado contiene una excesiva cantidad de metaloproteinasas que comprometen a la matriz extracelular. Hay que considerar que en los tejidos que rodean a las heridas crónicas los fibroblastos son sensibles e insensibles a ciertas citoquinas y factores de crecimiento.
La causa por la cual la herida se transforma en crónica, es multifactorial, la perfusión inadecuada de los tejidos o la isquemia, aumenta el riesgo de infección de la herida ya que el oxígeno es esencial para que los leucocitos destruyan las bacterias y se estimule la síntesis de fibroblastos. Cuando se produce la contaminación de una herida la carga bacteriana puede progresar hacia la colonización, luego a colonización crítica y finalmente a la infección. Los neutrófilos pueden extender la lesión tisular por la liberación de proteasas y productos tóxicos de oxígeno, hay déficit de factores de crecimiento y degradación de fibronectina lo cual dificulta la migración de fibroblastos.
La presencia del tejido necrótico en la herida, retrasa la cicatrización, la migración de los queratinocitos y fibroblastos está inhibida por la presencia de citoquinas y mediadores de la inflamación así también como está inducida la liberación de endotoxinas de la úlcera creando un medio favorable para el desarrollo bacteriano (12).
- Las células madre epidérmicas en el proceso de cicatrización
Las células madre son células que se caracterizan por su capacidad para autorrenovarse y diferenciarse hacia células de todos los linajes que constituyen su tejido de origen.
Las células madre se definen por dos características fundamentales:
- Su capacidad de autorrenovarse.
- Dar lugar a células diferenciadas de todos los linajes celulares que constituyen su tejido de origen.
Se han identificado células madre en distintos órganos, incluyendo la piel, el intestino, el músculo, el sistema hematopoyético e incluso en el cerebro humano. Estas células son las responsables de mantener la homeostasis del tejido donde se localizan y también de reparar el posible daño.
La epidermis y los folículos capilares albergan células madre que son indispensables para la homeostasis y la regeneración de la piel. Estas células madre también contribuyen a la reparación de heridas, lo que resulta en la restauración de la integridad del tejido y la función del tejido dañado.
Estas células son unipotentes en homeostasis, pero pueden dar origen a distintos tipos celulares para reparar la epidermis, siendo entonces multipotentes En la capa basal de la epidermis interfolicular coexisten dos tipos de progenitores: las células madre, caracterizadas por su división lenta, 4-6 veces al año, y una vida larga. Las células progenitoras de la capa basal, caracterizadas por su división más rápida, una vez por semana y vida más corta, ya que después de un número determinado de divisiones estas células experimentan diferenciación terminal hacia los queratinocitos diferenciados, perdiendo su capacidad de división.
En la parte inferior del folículo piloso se encuentra el bulbo piloso, que corresponde a la progenie comprometida de las células madre del bulge, y que apoya sobre la papila dérmica. La papila dérmica contiene fibroblastos dérmicos especializados, fibras nerviosas y un bucle capilar, y desempeña un papel fundamental en el desarrollo del folículo piloso y en el control del ciclo del pelo en la edad adulta. Las células de la papila dérmica tienen la capacidad de diferenciarse hacia linajes neuronales y mesodérmicos.
Las células madre localizadas en las glándulas sebáceas, en el infundíbulo y en las glándulas sudoríparas son multipotentes y también pueden contribuir en la homeostasia.
Las células madre epidérmicas son un tipo de célula multipotente y están comprometidas con la formación y diferenciación de la epidermis funcional.
La epidermis y el folículo piloso se mantienen y regeneran mediante la existencia de células madre. Residen en microambientes específicos llamados nichos que son importantes para modular el destino y la actividad de las células madre. Se han identificado tres nichos distintos de células madre epidérmicas en la piel. Estas son la capa basal de la epidermis, la “región protuberante” del folículo piloso y la base de las glándulas sebáceas. En condiciones de estado estable, cada nicho discreto mantiene su compartimento de tejido respectivo en unipotente (13).
En respuesta a la lesión, las células madre contribuyen a la reepitelización de las heridas. En lesiones de grosor completo, se ha demostrado que las células madre migran al sitio de la herida y contribuyen al proceso de curación de heridas.
Otras subpoblaciones de células madre residen dentro del folículo piloso, como las células madre de melanocitos, las células madre de tipo mesenquimatoso derivadas de la vaina dérmica y la papila dérmica. Todos los grupos de células madre contribuyen a la homeostasis epidérmica y a la cicatrización de heridas.
Las células madre exhiben un potencial de diferenciación considerable, que se define como plasticidad. Se reclutan en el área de la herida y promueven la reepitelización después de la lesión. La mayoría de la progenie se diferencia terminalmente. Pueden producir células diferenciadas, pero también se propagan para mantener un conjunto constante, dividiéndose simétricamente o asimétricamente. Cada nicho se comporta de forma unipotente, reponiendo su propio compartimento. Sin embargo, durante la cicatrización de heridas, adquieren la capacidad de reparar compartimentos vecinos, y estos compartimentos son capaces de repoblarse entre sí (14).
4. Mapas conceptuales


 Conclusión
Conclusión
Este trabajo permite un acercamiento a la fisiología en la cicatrización de heridas y a su complejo en- tramado, siendo profesionales de la salud, dedicados a la curación del paciente con heridas no debemos desconocer ya que repercute favorablemente en la calidad de atención.
Así se podrá reconocer en la valoración, el comportamiento favorable o no de las diferentes etapas del proceso y determinar una terapéutica adecuada y acorde a las circunstancias.
Por lo tanto, el conocimiento en la fisiología de la cicatrización repercute favorablemente en la curación de heridas.
Bibliografía
- Alberts B, Bray D, Hopking K, Jhonson A, Lewis J, Raff M et al. Introducción a la biología celular. Tercera edición Editorial Médica Panamericana. México. 2011 Cap.
- 531- 570.
- Fillella X, Molina R, Ballesta AM. Estructura y función de las citocinas. Medicina Integral. Barcelona. 2002; 39 (2)
63-71 https://www.elsevier.es/es-revista-medicina-integral-
63-pdf-13026682.
- Citoquina https://es.wikipedia.org/wiki/Citoquina.
- Burgos Miguez A. Recuerdo anatómico de la piel. Estructu- ra y funciones. 2012 https://www.portalesmedicos.com/ publicaciones/articles/4425/1/Recuerdo- anatomico-de-la- piel.-Estructura-y-funciones.
- Reiriz Palacios J. Tejidos. Membranas. Piel. Derivados de la piel. Colegio oficial de Enfermeras. http://www.infermera–virtual.com/
- Hartmann. Las heridas y su tratamiento. Ulceras.Net.2020. https://www.ulceras.net/monograficos.php.
- Bolgiani A. Protocolo de cura local de pacientes ambulatorios
CEPAQ. Enero de 2009.
- Primer Consenso de úlceras por presión. PriCUPP. Bases para la implementación de un Programa de Prevención, diag- nóstico y Tratamiento de las úlceras por presión. Coordinadores: Acad. Fortunato Benaim y Acad. Jorge Neira. Academia Na– cional de Medicina de Buenos Aires.2017.141 https://www. acamedbai.org.ar/PriCUPP.pdf.
- Tortora GJ, Derrickson B. Principios de anatomía y fisi- ología. 13ª Ed. Panamericana. 2011. Unidad 5. Sistema tegumentario.
- Merino Pérez J, Noriega Borge MJ. Fisiología General. La piel: estructura y funciones. https://ocw.unican.es/plugin- file.php/879/course/section/967/Tema%252011
- RodríguezM, Kosaric N, Bonham C, Gurtner G. Curación de heridas: una perspectiva celular. Physiol Rev. California.
2018.665 -706.
- Consenso sobre cicatrización de heridas de la Sociedad Ar- gentina de Dermatología. Bs As. 2008. https://sad.org.ar/ wp- content/uploads/2019/10/cicatrizacion.pdf.
- Yang R, Liu F, Wang J, Chen X, Xie J, Xiong K. Epider- mal stem cells in wound healing and their clinical applications. Stem Cell Res Ther. 2019jul 29;10(1) 229.doi: 10.1186/ s13287-019-1312-z. Review.
- Rodriguez M, Kosaric N, Bonham CA, Gurtner GC. Wound Healing: A Cellular Perspective. Physiol Rev.2019 Jan. 1;99(1): 665-706.doi: 10.11152/phys- rev.00067.2017.Review.

