Viruses vs Bacteria: use of bacteriophages in burns infected by MDR microorganisms
Dra. Bevilacqua Lucia
Monografía
Rotación Patología y Tratamiento de las Quemaduras. Agosto-Diciembre2022.
Carrera de Especialista en Cirugía Plástica, Reconstructiva y Reparadora.
Universidad del Salvador
Prof. Dr. Alberto Bolgiani
lulabevi@hotmail.com / 1159588039
Resumen
Las heridas por quemaduras son especialmente sensibles a la infección por bacterias, sobre todo por microorganismos MDR, han sido y serán capaces de mutar evadiendo el blanco del antibiótico, generando la conocida resistencia antibiótica, siendo la multiresistencia un gran desafío para los médicos. Los bacteriófagos son entidades virales capaces de infectar bacterias, estos virus tienen una característica única de la que carecen la mayoría de los antimicrobianos, la capacidad de atacar bacterias específicas, preservando así la microbiota natural. Los fagos han vuelto a investigarse debido a esto último.
Palabras clave: Bacteriófagos, quemaduras infectadas
Abstract
Burn wounds are especially sensitive to infection by bacteria, especially by MDR microorganisms. They have been and will be able to mutate, avoiding the antibiotic target, generating the known antibiotic resistance, with multiresistance being a great challenge for doctors. Bacteriophages are viral entities capable of infecting bacteria, these viruses have a unique characteristic that most antimicrobials lack, the ability to attack specific bacteria, thus preserving the natural microbiota. Phages have come back under investigation due to the latter.
Keywords: Bacteriophages, infected burns
Introducción
En 1915, el bacteriólogo británico Frederick Twort descubrió un agente bacteriolítico que infectaba y mataba a las bacterias, pero, no fue capaz de saber qué era exactamente dicho agente, señalando en una de sus hipótesis que, entre otras posibilidades, podría tratarse de un virus. Frente a la incertidumbre, el microbiólogo canadiense Félix Hubert d’Herelle inició investigaciones del fenómeno en el año 1910 paralelamente a Twort, y fue en el año 1917 cuando anunció a la Academia Francesa con firmeza el descubrimiento de un invisible antagonista microbiano del bacilo de la disentería, afirmó que se trataba de un virus al cual llamó bacteriófago. Felix d’Herelle en contraste con Twort y algunos otros científicos que habían reportado fenómenos similares, tuvo pocas dudas sobre la naturaleza del fenómeno que estaba observando y afirmó que se trataba de un virus que parasitaba a las bacterias (1).
Las heridas por quemaduras son especialmente sensibles a la infección por muchas razones, la destrucción de la barrera epidérmica en combinación con la desnaturalización de proteínas y lípidos crea un medio favorable para el crecimiento microbiano. Como es imposible hacer la concentración requerida de los antibióticos introducidos sistémicamente en los tejidos dañados con alteración de la circulación sanguínea local, la aplicación de preparaciones antimicrobianas se vuelve cada vez más vital (2).
Los bacteriófagos son entidades virales capaces de infectar bacterias, a pesar de estar oscurecidos por la practicidad y el amplio espectro de los antibióticos en la década de 1940, estos virus tienen una característica única de la que carecen la mayoría de los antimicrobianos, la capacidad de atacar bacterias específicas, preservando así la microbiota natural. Además las bacterias han sido y serán capaces de mutar evadiendo el blanco del antibiótico, generando la conocida resistencia antibiótica, siendo la multiresistencia un gran desafío para los médicos. Los fagos han vuelto a investigarse debido a esto último. ¿Serán capaces las bacterias de camuflarse evadiendo a los fagos en un futuro?
Los fagos son seleccionados y manipulados por ingeniería genética y al igual que los antibióticos pueden ser modificados in vitro específicamente contra la bacteria infectante.
Una desventaja seria es que los antibióticos son utilizados tanto en forma dirigida como en forma empírica, acción que no sería factible con los fagos debido a que están creados y modificados para atacar bacterias específicas, lo que llevaría a tener que aguardar resultados de cultivos para iniciar tratamiento con los mismos, motivo que condujo a la disminución del interés en el uso de los fagos terapéuticos.
Debemos reconocer que el trabajo en equipo en el ámbito de salud es de suma importancia, también debemos comprender que es de gran beneficio que los fagos pueden actuar de manera sinérgica con los antibióticos tradicionales al atacar los mecanismos de resistencia bacteriana desde el interior. De esta manera no se debe entender como un desplazamiento de tan útil herramienta.
Método
Revisión bibliográfica acerca de la eficacia y seguridad de los fagos, así como de los avances en esta no tan nueva pero prometedora terapia antibacteriana. La búsqueda se realizó en PubMed utilizando los siguientes términos: (“Bacteriophage” OR “Phage”) AND (“Infected burns”), aplicando filtro de los últimos 5 años.
Resultados
A octubre de 2021, hay aproximadamente 20 ensayos clínicos que reclutan pacientes con una terapia de fagos como intervención, uno de los cuales es de Fase III (3).
El estudio más conocido es PhagoBurn, un ensayo de fase I/II, aleatorizado, controlado y doble ciego, durante el periodo comprendido de julio 2015 a enero 2017, el cual tuvo como objetivo comparar la eficacia y la tolerabilidad de un cóctel de bacteriófagos líticos anti-Pseudomonas aeruginosa con el estándar de atención para pacientes con quemaduras. Fueron reclutados 25 pacientes con infección clínica por P. aeruginosa, el grupo control estándar consistía en sulfadiazina de plata y el grupo de estudio en un cóctel de 12 bacteriófagos líticos naturales anti-P aeruginosa, en distribución 1:1, ambos tópicos y por 7 días. El ensayo se detuvo el 2 de enero de 2017 debido a la eficacia insuficiente del fago, se cree que se debió a concentración insuficiente del fago después de la fabricación. Hubo mayor porcentaje de eventos adversos en el grupo control estándar (54%) que en el grupo de fagos (23%), de los cuales un paciente <8%> sufrió sepsis por Pseudomona, lo cual pudo deberse a falta de eficacia (4).
Internacionalmente el 60 % de las infecciones reportadas son resistentes a los agentes antimicrobianos. En América Latina, las cepas bacterianas más peligrosas han sido denominadas ESKAPE: Enterococcus faecalis, Staphylococcus aureus, Klebsiella, Acinetobacter baumanii, Pseudomonas aeruginosa y Escherichia coli.
Las grandes compañías farmacéuticas han perdido el interés en la búsqueda de nuevos antibióticos. Una de las razones podría ser que la duración de un tratamiento con agentes antimicrobianos es limitada, lo cual es menos ventajoso económicamente que la producción de medicamentos para el tratamiento de otras enfermedades, como las cardiovasculares, neurológicas, músculo-esqueléticas o el cáncer, de uso crónico y venta continua ilimitada.
Algunas bacterias intrahospitalarias son resistentes a todos los antibióticos aprobados y son únicamente tratadas con medicamentos experimentales y potencialmente tóxicos. Por lo antes expuesto, los científicos y médicos están reevaluando retrospectivamente la problemática para encontrar un tratamiento efectivo en la terapia con fagos.
La eficacia de la terapia con fagos fue demostrada en ensayos clínicos, pacientes que no respondían a tratamientos convencionales, fueron tratados satisfactoriamente con fagos. Además, no se reportaron efectos secundarios. Se destaca su seguridad ecológica, ya que se encuentran distribuidos en la naturaleza, son inofensivos a los humanos, a las plantas y a los animales, debido a su gran especificidad por el receptor bacteriano. Por presiones reguladoras de la FDA, fueron suspendidos los ensayos en los 90´, creemos que podría significar el desplazamiento de terapias ya comercializadas, y su consecuente pérdida económica para las industrias farmacéuticas que no debe ignorarse.
En contraste, la terapia con fagos comenzó y fue extensivamente utilizada en la URSS, después de la Segunda Guerra Mundial, y se mantiene actualmente en Rusia. Algunos de los antiguos resultados soviéticos sobre los ensayos clínicos de la terapia con fagos en adultos e infantes fueron publicados. El análisis de los datos mostró la efectividad de los fagos contra sepsis estafilocócica, infección séptica de los pulmones (abscesos agudos y crónicos, neumonía crónica y bronquitis crónica) y osteomielitis. Los resultados de estos estudios también revelaron que el tratamiento combinado de fagos y antibióticos fue más efectivo que la monoterapia.
Las preparaciones de fagos han sido aplicadas por vía oral (líquidas o tabletas), local (en tampones, enjuagues y cremas), rectal, aerosol, por nebulizador y endovenosa.
Las quemaduras presentan una alta tasa de infecciones, sobre todo las quemaduras de 3er grado, y dentro de esta problemática se encuentran las infecciones por bacterias multirresistentes lo que aumenta la complejidad terapéutica, como por ejemplo ingresos y estadías hospitalarias para antibioticoterapia endovenosa. La terapia de fagos tópicos es prometedora en este tipo de casos, especialmente en las infecciones por gram negativos como la Pseudomona spp. Los fagos son capaces de hidrolizar el biofilm generado por estas bacterias.
Un estudio a enfatizado en la producción y control de calidad de un cóctel, compuesto exclusivamente por bacteriófagos líticos, diseñado para el tratamiento de infecciones por Pseudomonas aeruginosa y Staphylococcus aureus en pacientes con infecciones de quemaduras. La actividad de 82 bacteriófagos contra P. aeruginosa y 8 contra S. aureus de las colecciones del Instituto Eliava de Bacteriófagos, Microbiología y Virología (EIBMV), Tbilisi, Georgia y el Instituto Estatal de Genética y Selección de Microorganismos Industriales (SIGSIM), Moscú, Rusia, se determinó frente a un total de 113 cepas de P. aeruginosa y 99 de S. aureus, aisladas de diferentes hábitats clínicos y ambientales de todo el mundo.
Se seleccionaron ocho bacteriófagos (PT6, PT8, PNM, 14/1, 9/3, F77, PL e ISP) para su posterior comparación con 23 cepas de P. aeruginosa y 17 de S. aureus, aisladas recientemente de pacientes en el Centro de Quemados del Hospital Militar Reina Astrid de Bruselas. Esto resultó en la selección de tres bacteriófagos que exhibieron una amplia gama de actividad de huéspedes, específicos para los aislamientos de heridas por quemaduras: PNM, 14/1 (contra P. aeruginosa) e ISP (contra S. aureus). El cóctel llamado BFC-1 consta de estos últimos tres bacteriófagos suspendidos en solución fisiológica.
En la figura 1 se demuestra como los bacteriófagos se adsorbieron (y mataron) a sus respectivos huéspedes. Con respecto a la toxicidad, la adición del cóctel de bacteriófagos al medio de cultivo no tuvo impacto en la viabilidad, proliferación ni morfología de los queratinocitos. Las endotoxinas poseen un alto grado de toxicidad y su eliminación es esencial para la seguridad en la terapia con bacteriófagos antibacterianos, en este cóctel se utilizó un kit de purificación de endotoxinas. No hay necesidad de controlar la ausencia de pirógenos si la aplicación es tópica, no así si se administra por vía EV. Un pH entre 6,0 y 8,0 garantiza la estabilidad de la infectividad de los bacteriófagos. BFC-1 se evalúa actualmente en un ensayo clínico, que fue aprobado por el Comité Ético de la “Universitair Ziekenhuis” de la “Vrije Universiteit Brussel” y comenzó en octubre de 2007. Hasta la fecha, BFC-1 se ha aplicado tópicamente sobre las heridas por quemadura infectadas de ocho pacientes. No se observaron eventos adversos (5).

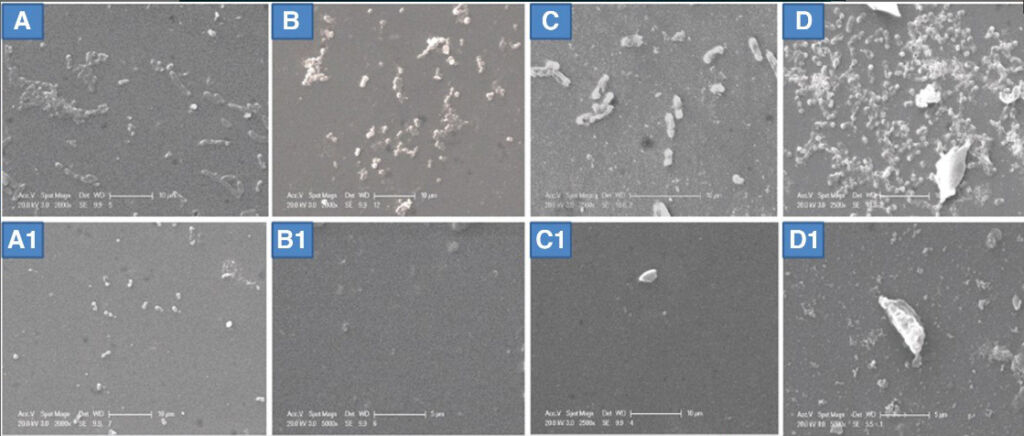
Otro estudio se publicó en septiembre 2021, acerca de bacteriófagos líticos contra biofilms bacterianos formados por Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae y Staphylococcus aureus resistentes a múltiples fármacos aislados de quemaduras infectadas.
Se analizó la capacidad de los bacteriófagos para inhibir la formación de biopelículas, in vitro.
En este estudio intentaron analizar los cambios morfológicos que pueden ocurrir como consecuencia de la acción de los bacteriófagos sobre los biofilms, los cuales se caracterizaron por microscopía electrónica.
La biomasa de los biofilms producidos se redujo drásticamente cuando se incubaron durante 2 o 4 h con los bacteriófagos, se redujeron en más del 50-80 % de manera dependiente del tiempo.
La formación de biopelículas fue claramente evidente en P. aeruginosa, S. aureus, K. pneumoniae y E. coli sin tratar y en condiciones dinámicas (Fig. 2A-D). El tratamiento con los respectivos fagos durante 4 h resultó en un menor contenido de biofilm en comparación con el control no tratado (Fig. 2A1-D1) (6).
El primer Simposio Europeo sobre fagoterapia se celebró en Alemania en 2017. En el curso de aquella conferencia de 3 días, participantes de 20 países estaban discutiendo los problemas relacionados con la terapia con fagos y la aplicación de fagos en general. Un resultado visible de este evento fue la fundación del Foro Nacional de Fagos (www.nf-phagen.de).
En resumen del simposio, los participantes creen que los siguientes factores pueden servir como argumentos “profagos”: (2)
– La alta especificidad de fago permite evitar la disbiosis en los medios tratados;
– los efectos secundarios tóxicos están ausentes;
– la autorreplicación está restringida;
– la aparición de resistencia a un fago no causa resistencia generalizada a otros fagos;
– las bacterias resistentes a los fagos suelen ser menos virulentas;
– las reservas de fagos en la naturaleza son prácticamente inagotables;
– los fagos son efectivos incluso contra bacterias MDR/ESKAPE
– las proteínas-lisinas de fago se pueden utilizar como alternativa;
– los fagos no son caros;
– son posibles varias formas de introducción de fagos;
– preparaciones de fagos específicos se pueden preparar dentro de un tiempo razonable.
Los siguientes argumentos se refieren al “contra fago”:
– Los fagos llegan con dificultad a los patógenos intracelulares;
– la vida efectiva/estabilidad puede variar de un fago a otro, lo que requiere un control periódico del título de fagos;
– los médicos deben adquirir nuevos conocimientos para utilizar los fagos;
– algunas partes del cuerpo humano pueden ser difíciles para la aplicación de fagos (por ejemplo, huesos, articulaciones, heridas profundas).
Discusión
Estos hallazgos respaldan el posible uso de bacteriófagos para el desarrollo de alternativas a los antibióticos o en conjunto con estos para el tratamiento de heridas infectadas con bacterias multirresistentes.
La utilización terapéutica de los fagos es promisoria dada las potencialidades que ofrece la terapia combinada de preparaciones de fagos y antibióticos, en comparación con la monoterapia. Sin lugar a dudas, el desafío principal para el uso seguro de los fagos será la realización de ensayos clínicos a gran escala, de acuerdo con las entidades reguladoras más rigurosas. Para ello será necesaria la implementación de nuevas regulaciones para evaluar la efectividad terapéutica de los fagos.
Conclusión
El objetivo a largo plazo será establecer los bacteriófagos como fármacos en la lucha contra las infecciones bacterianas y, como tales, obtener la autorización legal como productos medicinales en una variedad de formas de dosificación para diferentes indicaciones. Un primer paso en este ambicioso redescubrimiento es el desarrollo y producción de un producto a base de bacteriófagos contra las bacterias MDR según los estándares internacionales de calidad para medicamentos, y que el producto se sometiera a pruebas de seguridad y tolerancia en ensayos preclínicos y clínicos.


