 Severe pharmacoderma: experience of the National Center for Burns (CENAQUE) in Montevideo – Uruguay
Severe pharmacoderma: experience of the National Center for Burns (CENAQUE) in Montevideo – Uruguay
Antonella Gómez*, Ignacio Alvez**, Julio Cabrera***
jcabrera@cenaque.org.uy
Teléfono +598 99625370
*Prof. Adj.Medicina Intensiva
**Prof. Adj. Medicina Intensiva
***Prof. Agdo. de Medicina Intensiva, Encargado del Área de CTI del CENAQUE
Resumen
Introducción: el Centro Nacional de Quemados (CENAQUE) de Montevideo, Uruguay, asiste, desde su creación en el año 1995, no sólo a pacientes quemados por distintas causas, sino también aquellos afectados por farmacodermias severas que requieren ingreso a una Unidad de Cuidados Intensivos (UCI) especializada, donde se les brinda atención a través de un equipo interdisciplinario. Las reacciones cutáneas adversas de tipo inmunológico que caracterizan estas dermopatías son una importante causa de morbimortalidad. El CENAQUE es el centro de referencia a través del cual se asiste a estos pacientes que padecen dermopatías severas.
Objetivo: describir las características de la población afectada por las principales dermopatías (Sindrome de Stevens-Johnson -SSJ-, Sindrome de Solapamiento u Overlap, Necrólisis Epidérmica Tóxica -NET-) así como su evolución en el CENAQUE.
Material y método: estudio transversal, descriptivo, observacional. Se incluyeron los pacientes ingresados en el centro con diagnóstico de SSJ, Overlap, NET, en el período comprendido entre enero de 2004 y mayo de 2018 (14 años).
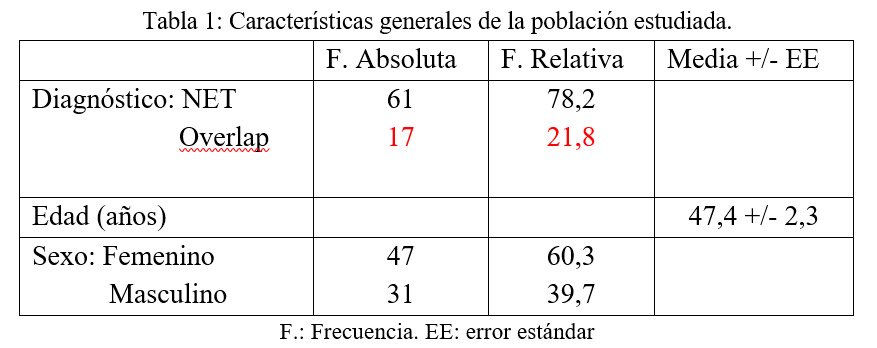
Resultados: se incluyeron 78 pacientes (17 Overlap, 61 NET), con un promedio de superficie corporal afectada del 60,4 +/- 2,9%.
El 100% presentó afectación de mucosas. De los fármacos sospechosos se destacan fundamentalmente los anticomiciales así como el Allopurinol. El tratamiento sistémico más utilizado fue la inmunoglobulina intravenosa en el 83,3% (65) de los pacientes. El tratamiento tópico más utilizado fue la Sulfadiazina Argéntica. La mortalidad fue del 18,7%.
Conclusiones:en esta población en particular pudo observarse que la mortalidad aumenta cuantos más factores de riesgo, según el score de SCORTEN, desarrolle el paciente. Los pacientes que en promedio tenían más de 55 años, presentaron una mayor tasa de mortalidad. Los pacientes que presentaron demora en los ingresos al centro de quemados también presentaron mayor tasa de mortalidad.
Palabras clave: Síndrome de Stevens-Johnson. Síndrome de Superposición. Necrólisis epidérmica tóxica.
Summary
Introduction: the National Center for Burns (CENAQUE) of Montevideo, Uruguay, has been assisting, since its creation in 1995, not only to patients burned by different causes, but also those affected by severe pharmacoderma that require admission to an Intensive Care Unit (ICU) specialized, where care is provided through an interdisciplinary team. The immunological adverse skin reactions that characterize these skin diseases are an important cause of morbidity and mortality. CENAQUE is the reference center through which these patients suffering from severe skin diseases are assisted.
Objective: to describe the characteristics of the population affected by the main skin diseases (Stevens-Johnson -SJS- syndrome, Overlap or Overlap Syndrome, Toxic Epidermal Necrolysis -NET-) as well as its evolution in CENAQUE.
Material and method: cross-sectional, descriptive, observational study. Patients admitted to the center with a diagnosis of SJS, Overlap, NET, in the period between January 2004 and May 2018 (14 years) were included.
Results: 78 patients (17 Overlap, 61 NET) were included, with an average of affected body surface area of 60.4 +/- 2.9%.
100% presented mucosal involvement. Of the suspected drugs, anticomial drugs and Allopurinol stand out. The most widely used systemic treatment was intravenous immunoglobulin in 83.3% (65) of the patients. The topical treatment most used was Silver Sulfadiazine. Mortality was 18.7%.
Conclusions: in this particular population, it could be observed that mortality increases as more risk factors the patient develops, according to the SCORTEN score. On average, the patients who were over 55 years old presented a higher mortality rate. Patients who had a delay in admission to the burn center also had a higher mortality rate.
Key words: Stevens – Johnson syndrome. Overlap Syndrome. Toxic epidermal necrolysis
Introducción
Las dermopatías secundarias a reacciones adversas por fármacos, constituyen una importante causa de morbimortalidad en todo el mundo, pudiendo ocasionar secuelas leves a severas (1). El antecedente previo de exposición a fármacos es crucial en el diagnóstico de las farmacodermias así como en una parte sustancial del tratamiento, ya que debe suspenderse el fármaco que las ocasionó. El SSJ y la NET son reacciones de hipersensibilidad mucocutánea causadas por fármacos y/o sus metabolitos (2). La NET es una reacción cutánea adversa de tipo inmunológico inducida por drogas y sus metabolitos, lo que conlleva a la apoptosis de los queratinocitos siendo el resultado el de una insuficiencia cutánea aguda (3). La NET, el SSJ y el síndrome de solapamiento forman parte del mismo espectro de enfermedad. Se diferencian por la extensión de la necrosis y el desprendimiento de la epidermis; de este modo, la extensión de la afectación es la siguiente: en el SSJ 10%, en el solapamiento entre 10 y el 30% y en la NET más de 30% (3). A través de un mecanismo autoinmune, se genera la apoptosis de los queratinocitos con el consiguiente desprendimiento de la epidermis sobre la dermis. Los principales inductores de la apoptosis son las células T CD8+ y citotóxicas junto con las células Natural Killer; proteínas como la Granulisina, secretada por los Linfocitos T y las células Natural Killer, pueden amplificar la extensión de la apoptosis. Los queratinocitos normales expresan en su superficie el receptor FAS (CD95), es un receptor transmembrana que al unirse al Fas Ligando (LFas) desencadena la apoptosis celular. Cuando las células mononucleares son estimuladas por drogas, a nivel sanguíneo se liberan grandes cantidades de Fas Ligando, generando la apoptosis y luego necrosis epidérmica con desprendimiento epidérmico. Se produce así una Insuficiencia Cutánea Aguda (ICA) la que se define como la pérdida de integridad de la piel mayor del 20% de la superficie corporal. Se generan alteraciones en las múltiples funciones que cumple la piel como órgano. Por su gravedad y extensión puede conducir a la aparición de las complicaciones sistémicas con riesgo de muerte.
Se ve alterada la función de barrera, termorreguladora, inmunológica, y función hormonal, siendo esto una verdadera emergencia dermatológica, con criterio de ingreso a un Centro de Quemados Críticos.
Cuando hablamos de la piel como barrera, debemos recordar que la misma otorga defensa mecánica frente a estímulos externos evitando entre otras cosas, la penetración de sustancias tóxicas y microorganismos, favoreciendo la colonización cutánea y posterior infección sistémica pudiendo ser la causa del fallo multiorgánico. Las infecciones son las complicaciones más temibles de la ICA, por ser la principal causa de muerte y de retraso de la reepitelización.
La piel como barrera evita alteraciones del medio interno. El estrato córneo presenta una matriz intercelular de lípidos que evitan las pérdidas de agua, electrolitos y calor.
La inflamación cutánea extensa produce hiperpermeabilidad capilar y salida de agua, electrolitos y albúmina al espacio intersticial. De forma secundaria aparece hipoalbuminemia, a la que contribuyen el hipercatabolismo endógeno de la albúmina y posiblemente una disminución en su síntesis. Todo lleva a una reducción importante del volumen intravascular, sindrome de hiperaldosteronismo secundario, insuficiencia renal prerrenal, esto ocasiona transtornos hemodinámicos como shock hipovolémico pudiendo agravar una posible situación de shock séptico. El incremento del flujo sanguíneo cutáneo aumenta el gasto cardiaco, esto puede conducir a trastornos hemodinámicos graves, más en pacientes con terrenos biológicos previos comprometidos.
La piel como termorregulador, conserva el calor mediante vasoconstricción y su propia estructura anatómica aislante, especialmente la grasa subcutánea; enfría por vasodilatación y evaporación del sudor. La pérdida de temperatura produce escalofríos, que conlleva a su vez, a un aumento del consumo de energía y por consiguiente a un estado de hipermetabolismo. Con frecuencia se produce una disminución de la secreción de insulina y una resistencia periférica a ésta que da lugar a hiperglicemia, glucosuria y secundariamente a una acidosis metabólica y un mayor consumo de proteínas como fuente de energía.
La inmunodebilidad está dada por liberación de citokinas de los queratinocitos destruidos (IL-1 y factor de necrosis tumoral alfa). Se puede presentar disminución de la actividad quimiotáctica y fagocítica de los granulocitos, descenso en los niveles de inmunoglobulinas séricas y de los linfocitos T circulantes CD4. Una menor actividad citolítica de las células T y NK y una proliferación de células T supresoras (4) (5) (6). El cuadro clínico es precedido por un pródromo de fiebre, malestar general, tos seca, sensación punzante a nivel ocular y dolor a nivel de la cavidad oral. En general se presenta de 1 a 3 semanas luego de la exposición al fármaco sospechoso. Hay rápida progresión a un exantema, desprendimiento epidérmico y mucositis erosiva de al menos 2 sectores, en general dentro de las 72 horas, pudiendo progresar hasta 1 semana donde comienza la etapa de reepitelización. El eritema temprano y doloroso de las palmas de las manos y las plantas de los pies es una característica importante. Aparecen ampollas y flictenas. En las zonas eritematosas se desprende al mínimo roce o con la presión digital, lo cual se conoce como signo de Nikolsky. Las lesiones se hacen confluentes y se transforman en un gran eritema difuso produciendo una insuficiencia cutánea similar a la que se observa en el paciente Gran Quemado, siendo éste un criterio de ingreso a una Unidad de Cuidados Intensivos especializada en Quemados (UCI-Q), buscando el manejo interdisciplinario (7)(8)(9).

Paciente con NET

Signo de Nikolski
La afectación gastrointestinal es una rara complicación de la NET que resulta en el desprendimiento del epitelio intestinal y compromete las mucosas esofágica, gástrica, del intestino delgado así como del colon (10). A nivel histológico se observan vesículas epidérmicas con extensa apoptosis de queratinocitos que conforman el techo de las mismas y en la dermis edema, congestión con extravasación de eritrocitos e infiltrado inflamatorio de distribución perivascular.
El pronóstico se determina a través del Score SCORTEN, que predice entre las 24-48 hs del inicio de los síntomas, la severidad de la enfermedad y el riesgo de muerte en pacientes con NET y síndromes relacionados. Se describen 7 factores de riesgo independientes de mortalidad elevada que se puntúan de forma sistemática, a fin de determinar la tasa de mortalidad (11)(12).

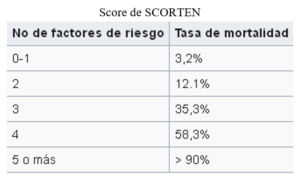
A pesar de un mejor conocimiento de la fisiopatología y de avances importantes en el tratamiento farmacológico de esta enfermedad, la mortalidad continúa siendo elevada: 1% a 5% para el SSJ y 25% a 35% para la NET pudiendo elevarse en pacientes añosos y aquellos con una gran superficie de desprendimiento epidérmico. La sepsis complicada con disfunción orgánica múltiple es la causa más común de muerte; más del 50% de los pacientes que sobreviven a la NET presentan secuelas a largo plazo (13).
Con respecto al tratamiento, el mismo será conducido en una UCI-Q. Lo primero es retirar el agente agresor. El médico intensivista actuará en conjunto con demás especialidades. Como siempre debe seguirse el esquema ABC (manejo de vía aérea, manejo respiratorio y hemodinámico) así como el sostén de órganos en falla. No está recomendada la profilaxis antibiótica. A nivel ocular hay que evitar las sinequias con lubricantes. A nivel oral se utilizarán agentes tópicos con antisépticos.
En relación con el tratamiento específico, el uso de inmunoglobulinas bloquea los receptores Fas, inhibiendo la apoptosis de queratinocitos. Se administran dosis de 2 a 4 g/Kg durante los primeros 4 días. Se ha reportado disminución de las lesiones cutáneas, menor duración de la enfermedad, así como mejoría de las tasas de sobrevida (14). La evidencia que apoya el uso de inmunoglobulina es limitada, en general no se ha podido demostrar un efecto beneficioso (15)(16)(17)(18). La Ciclosporina es un inhibidor de la Calcineurina, actúa sobre la IL-2, TNF alfa, IL-3, 4, CD40L, interferón gamma y el factor estimulante de colonias de granulocitos y monocitos reduciendo así la proliferación de células T, lo cual podría explicar su efecto beneficioso. Un reciente metaanálisis apoya la eficacia de la Ciclosporina en el manejo de la NET (19).
En cuanto al uso de corticoides, estudios observacionales han demostrado un aumento de las complicaciones y de la mortalidad asociados con su uso (20). Otros estudios muestran un efecto perjudicial con mayor riesgo de sepsis y mortalidad desaconsejando su uso para el tratamiento de la NET (21)(22).
Metodología
Se realizó una revisión retrospectiva de las historias clínicas codificadas con los diagnósticos de SSJ/ Overlap / NET entre 2004 y 2018.
Análisis estadístico
Se presenta la descripción con frecuencias absolutas y relativas para variables cualitativas, así como medidas de resumen para las continuas. En la búsqueda de asociación entre variables cualitativas se utilizó test de Chi cuadrado o exacto de Fisher si los valores esperados resultaran menores a 5. El estudio para diferencias de variables continuas se realizó con test t de Student para muestras independientes previo estudio de normalidad con test Kolmogorov- Smirnov. Se fijó un nivel de significación en 0,05. El análisis fue realizado con software STATA v.12.0.
Resultados
1-Clínica y epidemiología
El total de pacientes ingresados por dermopatía en el período de enero 2004 a mayo 2018 (14 años) correspondió a 149. De ellos, el 52,3% (78) presentaron las dermopatías de interés para el estudio. Esto determina que se encontró una prevalencia de dermopatías graves (Overlap y NET) de aproximadamente 52 pacientes de cada 100 ingresados en el período de estudio.
Dentro de los 78 pacientes de interés, se observó que la de mayor frecuencia correspondió a NET con el 78,2% (61) del total de casos.
En la siguiente tabla se describen características principales de la población estudiada y de los fármacos que recibieron previo al desarrollo de la dermopatía:
En relación con las disfunciones orgánicas al ingreso se observan las siguientes frecuencias de presentación, teniendo en cuenta que un mismo paciente pudo presentar más de una.
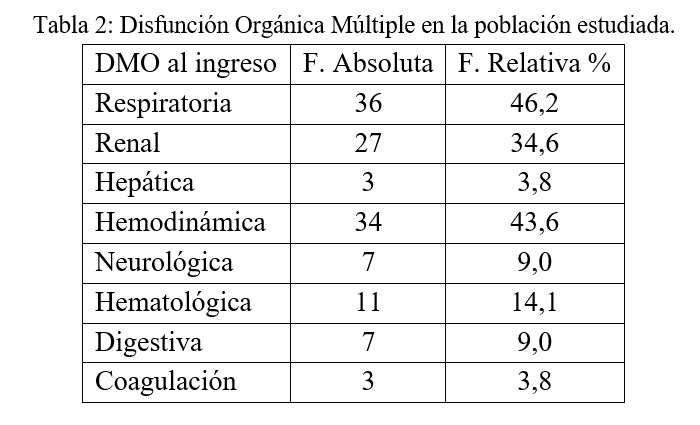
El compromiso hemodinámico estuvo presente en el 43% de los pacientes. El 21,8% (17) de los pacientes recibió Adrenalina, el 29,5% (23) recibió Noradrenalina. En estos grupos se incluye a 13 pacientes que recibieron ambas drogas.
En el polo respiratorio 46,2% (36) pacientes necesitaron Asistencia Respiratoria Mecánica invasiva, el 52,6% (41) restante no lo necesitó. Sólo a un paciente se le realizó ventilación no invasiva.
Con relación a la afectación de mucosa se observaron los siguientes resultados:

2-Mortalidad
En relación con el Score SCORTEN, se observó que el 59% (46) de los pacientes presentó hasta dos factores de riesgo lo que se asocia a una probabilidad de mortalidad menor versus la presencia de más factores de riesgo.
En esta población en particular pudo observarse que, al comparar la mortalidad prevista por el score y la mortalidad real observada, existe una asociación estadísticamente significativa, valor p < 0,001.
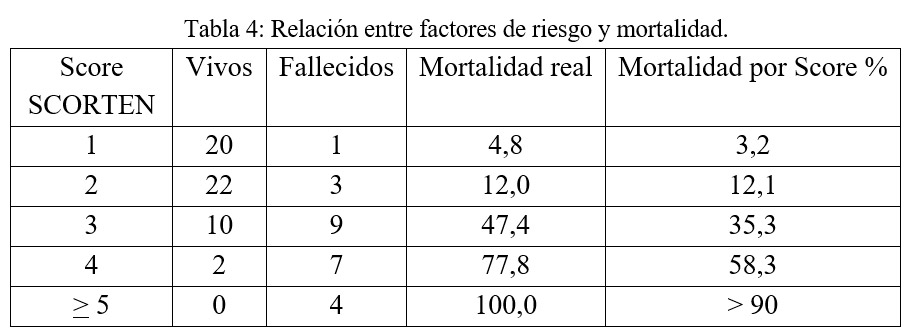
Puede observarse que a medida que aumenta el número de factores de riesgo, aumenta el porcentaje de fallecidos, lo que es esperable.

En la siguiente tabla se observa la relación entre la mortalidad y score de SCORTEN:
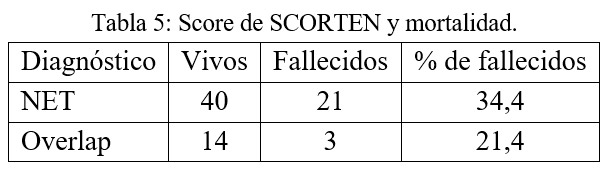
En los pacientes con NET la mortalidad observada entre 25% y 35% concuerda con datos de la literatura internacional.
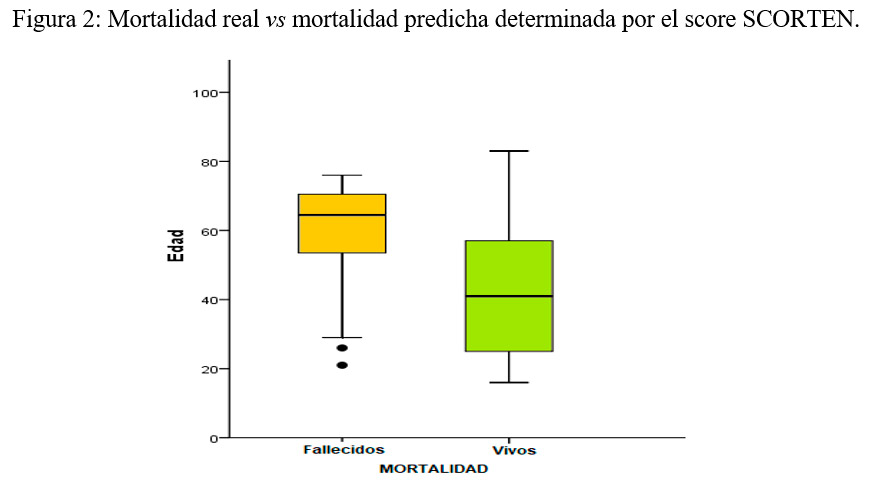
En relación con la superficie corporal afectada se presentó un promedio de afectación del 60,4 +/- 2,9%, en el caso de los pacientes que fallecieron dicho promedio fue de 67,6 +/- 5,6% siendo menor la afectación en los pacientes que sobrevivieron, de 57,2 +/- 3,3%; de todas formas esta diferencia no resultó ser estadísticamente significativa con un valor p = 0,096.
En el caso de los pacientes fallecidos, la edad promedio correspondió a 58,1 +/- 3,5 años, siendo significativamente menor en el grupo de pacientes que permanecieron vivos, 42,7 +/- 2,6 años, valor p < 0,001. La edad fue por lo tanto una variable con diferencias significativas con respecto a la mortalidad, presentando mayor mortalidad aquellos con más de 55 años.
3-Fármacos implicados
En relación con el tiempo de sensibilización se encontró una mediana de 13 días con un Rango Interquartil (RIQ) de 5 y 20 días. Esto explica que casi la mitad de los pacientes a los 13 días presentaron síntomas de la enfermedad, menos del 25% presentó síntomas con menos de 5 días o más de 25 días de exposición del fármaco.
4- Tratamiento y evolución
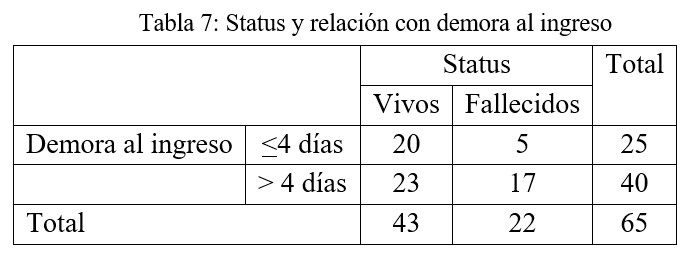
La mediana de demora al ingreso correspondió a 5 días, con RIQ en 3 – 7días. En el caso del grupo de pacientes que falleció la demora se eleva a 7 días y en los sobrevivientes se reduce a 4 días, encontrándose una diferencia estadísticamente significativa entre ambos tiempos, valor p= 0,041.
Aquellos pacientes con una demora al ingreso de 5 o más días presentaron una asociación estadísticamente significativa con una mayor probabilidad de fallecer, valor p= 0,043.
En relación con el tratamiento sistémico utilizado se observa que el 83,3% (65) de los pacientes recibieron inmunoglobulina. De los pacientes que la recibieron fallecieron el 27,7% (18); en aquellos pacientes que no la recibieron, la mortalidad fue de 75,0% (2) no pudiendo comprobarse una asociación estadísticamente significativa, valor p=0,205 dado que solo 3 pacientes no recibieron Inmunoglobulinas.
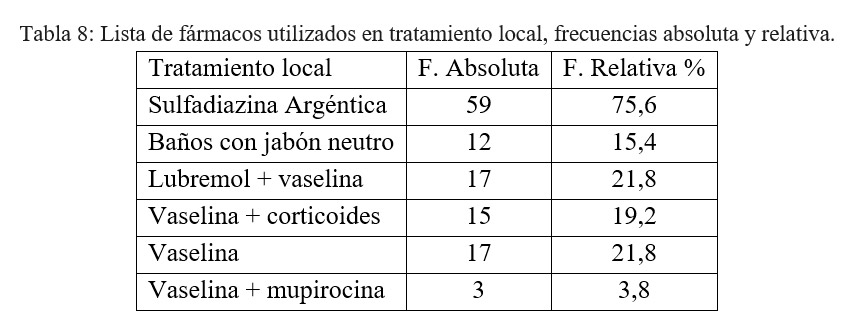
En relación al tratamiento local en la siguiente tabla se observa que la Sulfadiazina Argéntica resultó ser el tratamiento local más frecuentemente utilizado:
Discusión
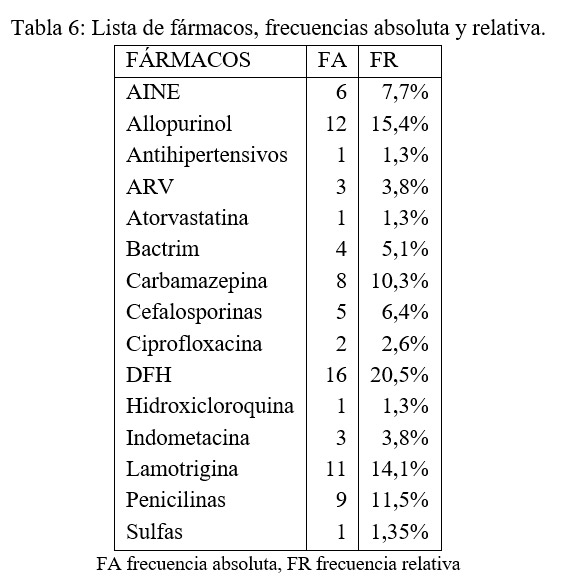
SSJ/Overlap/NET se consideran variantes de una misma entidad, causadas frecuentemente por fármacos. Cualquier fármaco puede desencadenar esta enfermedad, pero los más frecuentemente implicados en nuestra serie fueron los anticomiciales, el Allopurinol, ß-lactámicos y antirretrovirales (23)(24)(25). Como fármaco individual, el más frecuente fue la Comitoína.
Según la literatura, el mayor riesgo de desarrollar un SSJ/Overlap/NET ocurre durante las 8 primeras semanas tras la exposición al fármaco (23), según nuestros datos, este intervalo quedaría entre la primera y la segunda semana de exposición al fármaco. Se registraron casos con un tiempo de sensibilización de más de 20 días luego de la exposición. Se debe sospechar una toxicodermia aún cuando la exposición al fármaco haya sido alejada en el tiempo.
Las bases para el tratamiento del SSJ/Overlap/NET son la identificación y el retiro inmediato de los fármacos responsables y el ingreso precoz en un centro de quemados (24).
Los pacientes que ingresan precozmente a la unidad de quemados tienen una menor mortalidad. La suspensión temprana de todos los tratamientos sospechosos es esencial siendo el factor pronóstico de mayor importancia.
Respecto a los tratamientos sistémicos propuestos para el SSJ/Overlap/NET, los datos siguen siendo contradictorios. No hay evidencia suficiente sobre la superioridad de ningún tratamiento. En nuestra serie, más del 80% recibió Inmunoglobulinas como tratamiento sistémico.
En nuestro centro se utilizó en el 75% de las dermatopatias la Sulfadiazina Argéntica que resultó ser una terapia eficaz y segura sin que se hayan registrado complicaciones directas tras su indicación.
La mortalidad según la literatura internacional se aproxima mucho a la de nuestra serie, siendo de un 35% para la NET.
Observamos que no ingresaron en la unidad de quemados SSJ, dado que los pacientes ingresados todos tenían más de un 10 % de superficie corporal comprometida, por definición ingresaron como Overlap en transición con NET. Creemos de forma subjetiva, que cuando el compromiso de piel o mucosas es menos del 10 %, muchas veces es subestimado por el primer médico que lo valora al ingreso, momento en que la enfermedad es muy incipiente, y se interpretan como dermopatías de leve entidad. Como consecuencia no ingresan como SSJ al centro, pero sí ingresan cuando el estado clínico está más avanzado. De este modo no podemos cuantificar cual es la verdadera mortalidad de los SSJ ingresados dado que no logramos captarlos de forma precoz, la mortalidad se refiere a Overlap/NET.
El complejo SSJ/Overlap/NET es una verdadera urgencia dermatológica que requiere atención por equipos multidisciplinarios, para tomar decisiones en conjunto y definir el rápido ingreso a cuidados de quemados críticos.
Conclusiones
En esta población en particular pudo observarse que, al comparar la mortalidad prevista por el score SCORTEN y la mortalidad real observada, existe una asociación estadísticamente significativa con un valor p < 0,001.
En el caso de los pacientes fallecidos, la edad promedio correspondió a 58,1+/- 3,5 años, siendo significativamente menor en el grupo de pacientes que permanecieron vivos, 42,7 +/- 2,6 años con un valor p < 0,001. La edad fue por lo tanto una variable con diferencias significativas con respecto a la mortalidad, presentando mayor mortalidad aquellos pacientes con más de 55 años.
La demora al ingreso de 5 o más días se asoció significativamente con una mayor mortalidad con un valor p = 0,043.
Referencias Bibliográficas
-
Koraisha H, Anisa M, Ncoza C et al. An Update on Adverse Cutaneous Drug Reactions in HIV/AIDS. Dermatopathology 2019;6:111–125.
-
Papp A, Sikora S, Evans M et al. Treatment of toxic epidermal necrolysis by multidisciplinary team. A review of literature and treatment results. Burns 2018;44(4):807-815.
-
Bastuji-Garin S, Rzany B, Stern RS, Shear NH, Naldi L, Roujeau JC. Clinical Classification of Cases of Toxic Epidermal Necrolysis, Stevens-Johnson Syndrome, and Erythema Multiforme. Arch Dermatol. 1993;129(1):92–6.
-
French LE, Trent JT, Kerdel FA. Use of intravenous immunoglobulin in toxic epidermal necrolysis and Stevens-Johnson syndrome: Our current understanding. Int Immunopharmacol. 2006;6(4):543–9.
-
Chung WH, Hung SI, Yang JY, Su SC, Huang SP, Wei CY, et al. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis. Nat Med. 2008;14(12):1343–50.
-
Mockenhaupt M, Viboud C, Dunant A, Naldi L, Halevy S, Bavinck JNB, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: Assessment of medication risks with emphasis on recently marketed drugs. The EuroSCAR-study. J Invest Dermatol. 2008;128(1):35–44.
-
Maity S, Banerjee I, Sinha R et al. Nikolsky´s sign: A pathognomonic boon. J Family Med Prim Care.2020 Feb 28;9(2):526-530.
-
Current Perspectives on Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis. Clin Rev Allergy Immunol.2018 Feb;54(1):147-176.
-
Practical guidelinesfor the management of toxic epidermal necrolysis and Stevens-Johnson syndrome. Int J Dermatol. 2007 Oct;46(10):1092-4.
-
Brown CS, Defazio JR, An G, O’Connor A, Whitcomb E, Hart J, et al. Toxic Epidermal Necrolysis with Gastrointestinal Involvement: A Case Report and Review of the Literature. J Burn Care Res. 2017;38(1):e450–5.
-
Seecof O, Liantonio J. Prognostication using SCORTEN in SJS and TEN. J Pain Sym Man. 2019;57(1):e8-e9.
-
Bansal S, Garg VK, Sardana K, Sarkar R. A clinic therapeutic analysis of Stevens-Johnson syndrome and toxic epidermal necrolysis with an emphasis on the predictive value and accuracy of SCORe of Toxic Epidermal Necrolysis. Int J Dermatol.2015 Jan;54(1):e18-26.
-
Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome. Rev du Prat. 2007;57(11):1165–70.
-
Ferrandiz-Pulido C, Garcia-Patos V. A review of causes of Stevens-Johnson syndrome and toxic epidermal necrolysis in children. Arch Dis Child. 2013;98(12):998–1003.
-
Roujeau JC, Bastuji-Garin S. Systematic review of treatments for Stevens–Johnson syndrome and toxic epidermal necrolysis using the SCORTEN score as a tool for evaluating mortality. Ther Adv Drug Saf [Internet]. 2011;2(3):87–94. Available from: https://doi.org/10.1177/2042098611404094
-
Huang YC, Li YC, Chen TJ. The efficacy of intravenous immunoglobulin for the treatment of toxic epidermal necrolysis: A systematic review and meta-analysis. Br J Dermatol. 2012;167(2):424–32.
-
Barron SJ, Del Vecchio MT, Aronoff SC. Intravenous immunoglobulin in the treatment of Stevens-Johnson syndrome and toxic epidermal necrolysis: A meta-analysis with meta-regression of observational studies. Int J Dermatol. 2015;54(1):108–15.
-
Barvaliya MJ, Patel MK, Patel TK, Tripathi CB. Toxic epidermal necrolysis due to lamotrigine in a pediatric patient. J Pharmacol Pharmacother. 2012;3(4):336–8.
-
González-Herrada C, Rodríguez-Martín S, Cachafeiro L, Lerma V, González O, Lorente JA, et al. Cyclosporine Use in Epidermal Necrolysis Is Associated with an Important Mortality Reduction: Evidence from Three Different Approaches. J Invest Dermatol. 2017;137(10):2092–100.
-
Estrella-Alonso A, Aramburu JA, González-Ruiz MY, Cachafeiro L, Sánchez MS, Lorente JA. Toxic epidermal necrolysis: A paradigm of critical illness. Rev Bras Ter Intensiva. 2017;29(4):499–508.
-
Chave TA, Mortimer NJ, Sladden MJ, Hall AP, Hutchinson PE. Toxic epidermal necrolysis: Current evidence, practical management and future directions. Br J Dermatol. 2005;153(2):241–53.
-
Sekula P, Dunant A, Mockenhaupt M, Naldi L, Bouwes Bavinck JN, Halevy S, et al. Comprehensive survival analysis of a cohort of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. J Invest Dermatol. 2013;133(5):1197–204.
-
Halevy S, Ghislain PD, Mockenhaupt M, Fagot JP, Bouwes Bavinck JN, SidoroffA,et al. Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel. J Am Acad Dermatol.2008;58:25–32.
-
Roujeau JC, Kelly JP, Naldi L, Rzany B, Stern RS, Anderson T, et al. Medication use and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. N Engl J Med. 1995;333:1600–7.
-
Mao Martín L, Hernández Blanco C, Antolín Arias J, Cabello Carro J. Imagen de la semana. MedClin (Barc). 2008;131:320.
-
Freiman A, Borsuk D, Sasseville D. Dermatologic emergencies. CMAJ.2005;173:1317–9.

