Wnt signaling pathways: an essential route in cell reprogramming, homeostasis and tissue regeneration. The future in the treatment of skin injured by burns.
Dra. Daniela Segales Peralta
Tutor: Dr. Prof. Alberto Bolgiani
Ciudad Autónoma de Buenos Aires.
daniela.segales@gmail.com
- Resumen
La señalización del factor de crecimiento es necesaria para la diferenciación celular, la morfogénesis tisular y la homeostasis tisular. Una familia de factores de crecimiento importante para estos aspectos está dada por las proteínas Wnt. El nombre Wnt es un acrónimo creado a partir de los nombres Wingless e Int-1. El conocimiento de la señalización del factor de crecimiento durante la diferenciación permitirá mejorar la diferenciación dirigida de células madre embrionarias o adultas. La señalización Wnt se identificó primero por su papel en la carcinogénesis, luego por su función en el desarrollo embrionario.
En 2012, John B. Gurdon y Shinya Yakamana fueron galardonados con el Premio Nobel de Medicina por su descubrimiento sobre cómo las células adultas se podían reprogramar para transformarse en pluripotentes (iPS), capaces de comportarse de forma similar a las células madre embrionarias, de ahí su importancia en medicina regenerativa y con la comprensión de la reprogramación celular se entiende la clave que desempeña la ruta de señalización Wnt en la transformación de células adultas a células iPS.
La ruta de señalización Wnt está formada por una serie de reacciones bioquímicas que se producen en las células. En las ranas o en los lagartos, estas reacciones son las que permiten que se regeneren las extremidades si los animales sufren alguna herida. Si bien los seres humanos y los mamíferos en general han perdido esta capacidad de regeneración, la ruta Wnt está implicada en numerosos procesos durante el desarrollo embrionario y la fusión celular, y también durante la reprogramación.
Varios investigadores y algunos laboratorios han desarrollado moléculas que aplicadas sobre las heridas en ratas y algunos pocos en humanos, han obtenido resultados muy alentadores, obteniendo, menor tiempo de epitelización, mejor distribución de melanocitos y menor cicatriz hipertrófica.
Palabras clave: vía de señalización Wnt, regeneración tisular.
Abstract
Growth factor signaling is necessary for cell differentiation, tissue morphogenesis, and tissue homeostasis. An important family of growth factors for these aspects is given by the Wnt proteins. The name Wnt is an acronym created from the names Wingless and Int-1. Knowledge of growth factor signaling during differentiation will improve targeted differentiation of embryonic or adult stem cells. Wnt signaling was first identified for its role in carcinogenesis, then for its role in embryonic development.
In 2012, John B. Gurdon and Shinya Yakamana were awarded the Nobel Prize in Medicine for their discovery of how adult cells could be reprogrammed to become pluripotent stem cells (iPSCs), capable of behaving similarly to embryonic stem cells, hence its importance in regenerative medicine and with the understanding of cell reprogramming, the key that the Wnt signaling pathway plays in the transformation of adult cells to iPS cells is understood.
The Wnt signaling pathway is formed by a series of biochemical reactions that occur in cells. In frogs or lizards, these reactions are what allow limbs to regenerate if the animals suffer an injury. Although humans and mammals in general have lost this ability to regenerate, the Wnt pathway is involved in numerous processes during embryonic development and cell fusion, as well as during reprogramming.
Several researchers and some laboratories have developed molecules that, applied to wounds in rats and a few in humans, have obtained very encouraging results, obtaining shorter epithelialization time, better distribution of melanocytes and less hypertrophic scarring.
Key words: Wnt signaling pathway, tissue regeneration.
- Introducción
La piel es el órgano más extenso y accesible de nuestro cuerpo, los procesos biológicos que regulan su homeostasis no son aún bien comprendidos. No es una simple barrera para protegernos o prevenir la pérdida de agua, sino uno de los tejidos más complejos y dinámicos de nuestro organismo, es tan compleja como el sistema nervioso, pero la primera se diferencia del segundo en un aspecto esencial: mientras que el cerebro no puede sustituir las neuronas dañadas, la piel se renueva constantemente y es capaz de reparar una herida, repoblando el tejido con nuevas células. El conocimiento de los fundamentos biológicos y moleculares que gobiernan la arquitectura, diferenciación y regeneración de la piel es crucial para comprender las enfermedades cutáneas y encontrar los tratamientos adecuados (1).
En los organismos eucariotas pluricelulares las células madre constituyen una población definida, caracterizada por 2 propiedades únicas: la capacidad de diferenciarse dando lugar a uno o más tipos celulares y la capacidad de autorrenovarse, originando células con el mismo potencial de diferenciación. Pueden ser de origen embrionario o adulto, las células madre adultas son responsables de mantener el equilibrio homeostático se localizan en lugares específicos denominados nichos que interaccionan con las células madre residentes, estableciendo la señalización molecular que regula su actividad proliferativa y diferenciadora (2). La posibilidad de revertir una célula somática de un adulto al estado pluripotencial de una célula embrionaria (una estrategia conocida en inglés como induced pluripotent stem cells o células iPS) ha atraído un enorme interés debido a su utilidad virtual en la medicina regenerativa.
El control homeostático de la epidermis es el resultado de la actividad de una pequeña población de células madre multipotenciales que se dividen raramente y poseen un elevado potencial de diferenciación. Esta población responde a las necesidades fisiopatológicas del tejido, originando un gran número de células progenitoras con un elevado poder de replicación y una baja capacidad de diferenciación que se extiende por el estrato basal de la epidermis, constituyendo una población celular transitoriamente amplificada (transit amplifying cells. TA). Cotsarelis et al. fueron los primeros en demostrar que la región prominente (bulge) del folículo piloso constituye un nicho de células madre epidérmicas (3).
Las células progenitoras de la región prominente del folículo no solo contribuyen a la regeneración del pelo, sino que participan en la cicatrización de heridas, ya que son capaces de emigrar a la epidermis interfolicular y diferenciar a queratinocitos (4). Esta población de células progenitoras exhibe una vigorosa multipotencia y es capaz de diferenciar in vitro no solo a queratinocitos, sino también a neuronas, glía, melanocitos y células mesenquimáticas y en los procesos angiogénicos que tienen lugar en la piel.
- El ciclo del folículo piloso
El folículo piloso es un modelo biológico bien estudiado en el ratón para entender la biología de las células madre epidérmicas y de las señales implicadas en el diálogo molecular que se establece entre el epitelio folicular y el tejido adyacente (interacción epitelio-mesénquima). El ciclo de crecimiento del folículo piloso cuenta de 3 fases: anágeno (crecimiento activo), catágeno (regresión) y telógeno (reposo) (5).
En la transición telógeno-anágeno, las señales moleculares provenientes de la papila dérmica (origen mesodérmico) inducen la división asimétrica de las células madre localizadas en la base del folículo, originando nuevas células madre y células TA, que migran y diferencian para formar un bulbo alrededor de la papila dérmica, el cual avanza hacia el interior de la dermis originando la zona cíclica del folículo. Hacia la mitad de la fase de anágeno las células madre localizadas en la región prominente abandonan el ciclo y retornan a su estado habitual de quiescencia. La fase de anágeno termina cuando el potencial proliferativo de las células TA se agota; e inicia la fase de catágeno, en la que el bulbo se degrada y la papila dérmica se retrae y asciende hasta ponerse en contacto con la región prominente (figs. 1A y 1B).
En la última década se han estudiado de forma rigurosa los mecanismos moleculares que regulan la actividad del folículo piloso. Así, ha podido establecerse que la vía de señalización Wnt/β-catenina desempeña un papel clave en el ciclo del folículo, activando las células madre e induciendo la transición de la fase de telógeno a la fase de anágeno 13 y se ha estudiado al mismo tiempo el efecto de la ADN metiltransferasa 1 (Dnmt1) en la señalización de Wnt/β-catenina y su impacto en la actividad de las células madre epidérmicas.
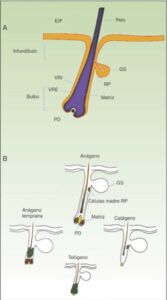
Figura 1.
A. Representación esquemática de un folículo piloso. B. El ciclo del folículo piloso.
EIF: epidermis interfolicular; GS: glándula sebácea; PD: papila dérmica; RP: región prominente; VRE: vaina radicular externa; VRI: vaina radicular interna.
Fuente: https://www.actasdermo.org/es-nuevos-modelos-experimentales-el-estudio-articulo
4. Vías de señalización Wnt
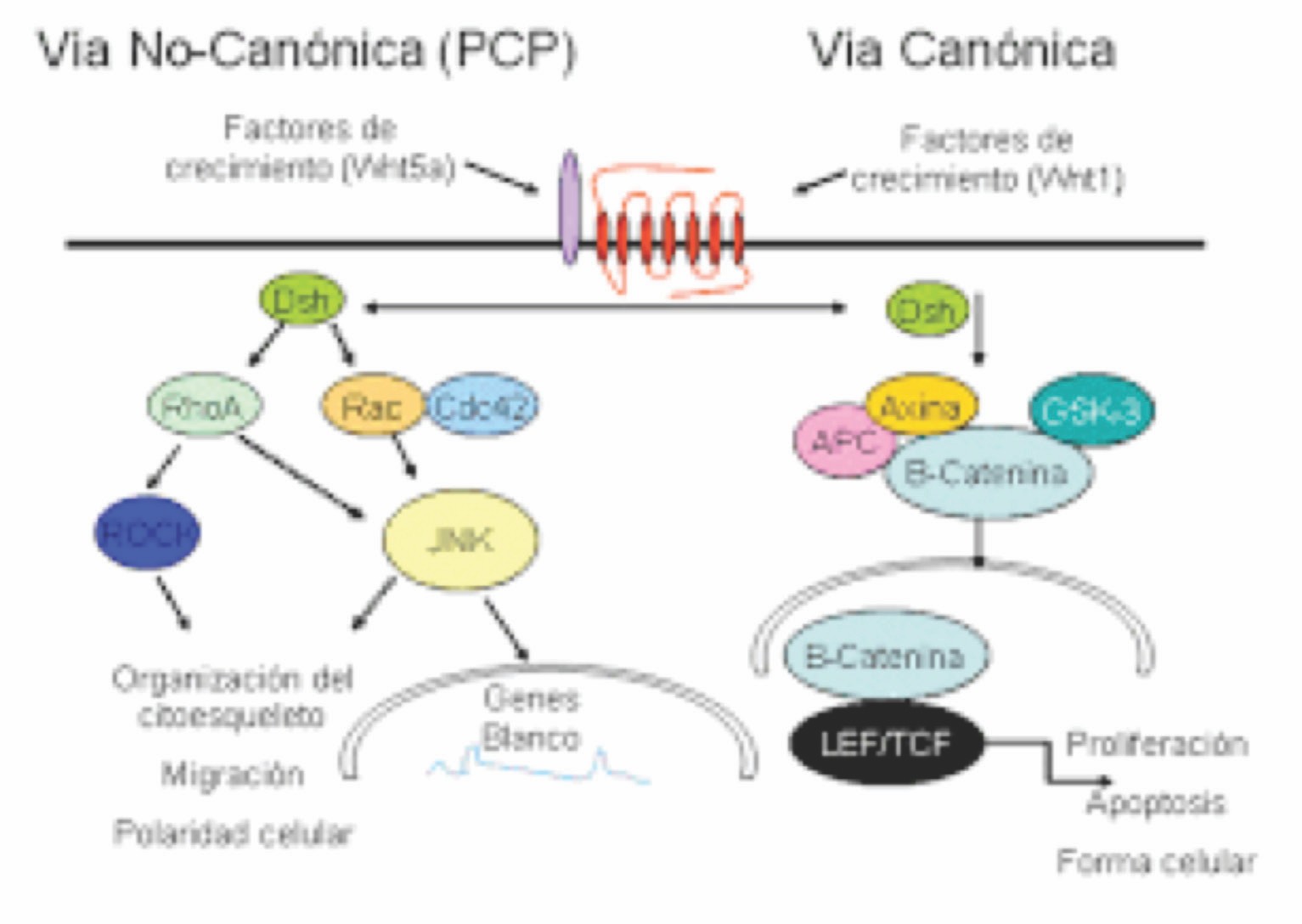
Son un grupo de vías de transducción de señales que comienzan con proteínas que pasan señales a una célula a través de receptores de la superficie celular. Las vías de señalización Wnt utilizan la comunicación célula-célula cercana (paracrina) o la comunicación entre las mismas células (autocrina). Se han caracterizado tres vías de señalización Wnt: la vía Wnt canónica, la vía de polaridad celular plana no canónica y la vía Wnt / calcio no canónico.
Las tres vías se activan por la unión de una proteína Wnt- ligando a un Frizzled familia receptor, que pasa la señal biológica a la proteína Dishevelled dentro de la célula. La vía canónica Wnt conduce a la regulación de la transcripción génica y se cree que está regulada negativamente en parte por el gen SPATS1. La vía de polaridad celular plana no canónica regula el citoesqueleto que es responsable de la forma de la célula. La vía no canónica Wnt / calcio regula el calcio dentro de la célula (6,7).
5. Historia
El descubrimiento de la señalización Wnt fue influenciado por la investigación sobre retrovirus oncogénicos. Los primeros pasos en la investigación de la señalización Wnt fueron dados en la década de 1970, cuando se identificó una mutación en un gen de Drosophila melanogaster que originaba un fenotipo sin alas. Debido a esta morfología particular, al gen se lo denominó Wingless (Wg) (8).
Estudios genéticos y bioquímicos posteriores realizados con diversos fenotipos mutantes de Drosophila melanogaster, establecieron la existencia de varios genes involucrados en defectos del desarrollo embrionario de la mosca, similares u opuestos a los observados con mutantes Wg. Posteriormente, fueron ordenados para conformar una ruta de señalización y se establecieron relaciones bioquímicas entre sus productos proteicos (9).
En 1982, Roel Nusse y Harold Varmus infectaron ratones con el virus del tumor mamario de ratón para mutar genes de ratón para ver qué genes mutados podían causar tumores de mama. Identificaron un nuevo protooncogén de ratón al que llamaron int1 (integración 1).
Int1 está altamente conservado en múltiples especies, incluidos humanos y Drosophila. Su presencia en D. melanogaster ha llevado a los investigadores a descubrir en 1987 que el gen int1 en Drosophila era en realidad el ya conocido como Wingless (Wg) establecida ya la función de Wg como un gen de polaridad de segmento involucrado en la formación del eje del cuerpo durante la fase embrionaria, los investigadores determinaron que el mamífero int1 descubierto en ratones también está involucrado en el desarrollo embrionario (10).
La investigación continua condujo al descubrimiento de más genes relacionados con int1 y debido a que esos genes no se identificaron de la misma manera que int1, la nomenclatura del gen int fue inadecuada. Por lo tanto, la familia int / Wingless se convirtió en la familia Wnt e int1 se convirtió en Wnt1. El nombre Wnt es un acrónimo de int y Wg y significa “sitio de integración relacionado con Wingless” (6).
6. Ligandos Wnt y sus vías de señalización
La señalización Wnt comienza cuando un ligando Wnt se une a su receptor en la membrana plasmática. La señalización más estudiada y mejor caracterizada es la vía Wnt/β-catenina o Wnt canónica. Además, entre las vías independientes de β-catenina o no canónicas, se encuentran la vía Wnt/polaridad celular plana (PCP) y la vía Wnt/Ca2+. Estas vías no se conocen en detalle y si bien se han estudiado y dilucidado parcialmente en Drosophila y en Xenopus, no se comprende muy bien su función biológica en mamíferos. Además, a diferencia del gran interés que despierta la vía Wnt/β-catenina debido a su relación con la tumorigénesis, es incierto el rol de las vías no canónicas en este proceso.
Las proteínas Frizzled son los receptores primarios de los ligandos Wnt y son miembros de la gran familia de receptores acoplados a proteína G de 7 dominios transmembrana. En humanos, se han definido 11 isoformas de receptores Frizzled . De esta manera, distintas combinaciones de pares de ligandos Wnt y receptores Frizzled pueden activar cada una de las señalizaciones Wnt y conducir así a respuestas celulares únicas.
En el hígado de ratones adultos, por ejemplo, se encontró que normalmente son expresados 11 ligandos Wnt y 9 receptores Frizzled, reflejando esto la gran diversidad de funciones que puede desencadenar la señalización Wnt dentro de un único tejido. Finalmente, la proteína Dishevelled (Dvl) interactúa con un dominio citoplasmático de Frizzled, transmitiendo la señal Wnt al interior celular (11, 12).
7. Vía de señalización Wnt/β-catenina
La vía Wnt/β-catenina o Wnt canónica tiene un rol central en el desarrollo embrionario y en la homeostasis del tejido adulto, participando en procesos de proliferación, diferenciación, movilidad, adhesión, regeneración, entre otros. La proteína β-catenina se aisló originalmente en células de mamífero como una proteína asociada a E-cadherina, que es una molécula de adhesión de la membrana celular. El nombre “catenina” proviene de la palabra en latín “catena” que significa cadena y refleja el rol de esta proteína en asociar a E-cadherina con el citoesqueleto de actina. En la figura 2. se esquematiza la vía Wnt canónica.
En ausencia de un ligando Wnt, la mayor parte de β-catenina se encuentra presente en las uniones adherentes celulares. Allí, junto a la proteína α-catenina, conectan a la proteína E-cadherina al citoesqueleto de actina (11). Fuera de las uniones adherentes, los niveles de β-catenina son bajos debido a un proceso de degradación proteica eficientemente regulado.
La población de β-catenina libre en el citosol es reconocida y capturada por un “complejo multiproteico de destrucción” Introducción 12 conformado por la proteína supresora de tumores APC (del inglés adenomatous polyposis coli), Axina 1/2, Glucógeno sintasa quinasa 3 beta (GSK3β) y Caseína quinasa 1 (CK1) (13). Dentro de este complejo, β-catenina es fosforilada en residuos específicos y conservados del extremo amino terminal, en primer lugar, por CK1 (Ser45) y posteriormente por GSK3β (Ser33, Ser37 y Thr41). Una vez fosforilada, β-catenina es reconocida por la proteína E3 ubiquitina ligasa βTrCP, que la poliubiquitina para su posterior degradación proteosomal (14). Por el contrario, la activación de la vía se logra mediante la unión de un ligando Wnt a un receptor Frizzled en la membrana plasmática, lo que permite la asociación de este último con el coreceptor LRP5/6 (del inglés low density lipoprotein (LDL) receptor-related protein 5/6), específico de la vía Wnt canónica (15). El complejo Frizzled-LRP5/6 interactúa con la proteína Dvl, que recluta entonces a axina, GSK3β y CK1. Las quinasas GSK3β y CK1 fosforilan a LRP5/6, que atrae a su vez a una mayor cantidad de axina, GSK3β y CK1 a la membrana plasmática. Este mecanismo conduce al desacoplamiento del complejo multiproteico de destrucción, generándose así la liberación de β-catenina y su posterior estabilización y acumulación en el citosol. La acumulación citosólica de β-catenina permite su translocación nuclear y su asociación con los factores de transcripción LEF/TCF (del inglés lymphoid enhancer factor/T cell factor). β-catenina actúa en el complejo nuclear como un coactivador transcripcional, estimulando la expresión de varios genes involucrados en el crecimiento y en la proliferación celular. Cuando β-catenina no tiene acceso al núcleo, los factores LEF/TCF se encuentran unidos a los corepresores Grg/TLE (del inglés groucho related gene/transducin-like enhancer of split),

Figura 2: Vía de señalización Wnt/β-catenina. Izquierda: en ausencia de un ligando Wnt, los niveles de β-catenina son regulados eficientemente por un complejo multiproteico de destrucción formado por APC, Axina, GSK3β y CK1. β-catenina es fosforilada en este complejo y finalmente degradada en proteosomas. La transcripción de los genes blanco de la vía se mantiene reprimida. Derecha: La unión de un ligando Wnt al complejo Frizzled/LRP5/6 desencadena una serie de señales intracelulares que conducen a la desestabilización del complejo multiproteico de destrucción. Esto permite la acumulación citosólica de β-catenina y su migración al núcleo, donde se une a los factores LEF/TCF. Se produce así la transcripción de los genes blanco de la vía a partir del complejo LEF/TCF/β-catenina. Fuente: https://rephip.unr.edu.ar/bitstream/handle.
8. Vías no canónicas
La vía de polaridad celular plana no canónica no involucra a la β-catenina, y activa la proteína G Rho que activa la quinasa asociada a Rho (ROCK), que es uno de los principales reguladores del citoesqueleto, Además interviene en la unión de la profilina a la actina y puede resultar en la reestructuración del citoesqueleto y la gastrulación (16). Figura 3.
La vía no canónica Wnt / calcio tampoco involucra a la β-catenina. Su función es ayudar a regular la liberación de calcio del retículo endoplásmico (RE) para controlar los niveles de calcio intracelular. El aumento de calcio también activa la calcineurina y CaMKII. CaMKII induce la activación del factor de transcripción NFAT, que regula la adhesión celular, la migración y la separación de tejidos. La calcineurina activa la quinasa TAK1 y NLK, que pueden interferir con la señalización de TCF / ß-Catenina en la vía Wnt canónica (6). Figura 4.
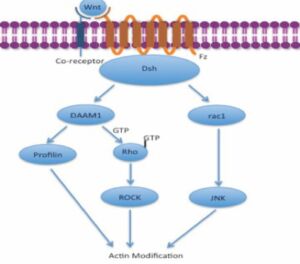
Figura 3. Vía de polaridad celular planar no canónica (PCP).
Fuente: https://www.wikiwand.com/es/Se%C3%B1alizaci%C3%B3n_paracrina
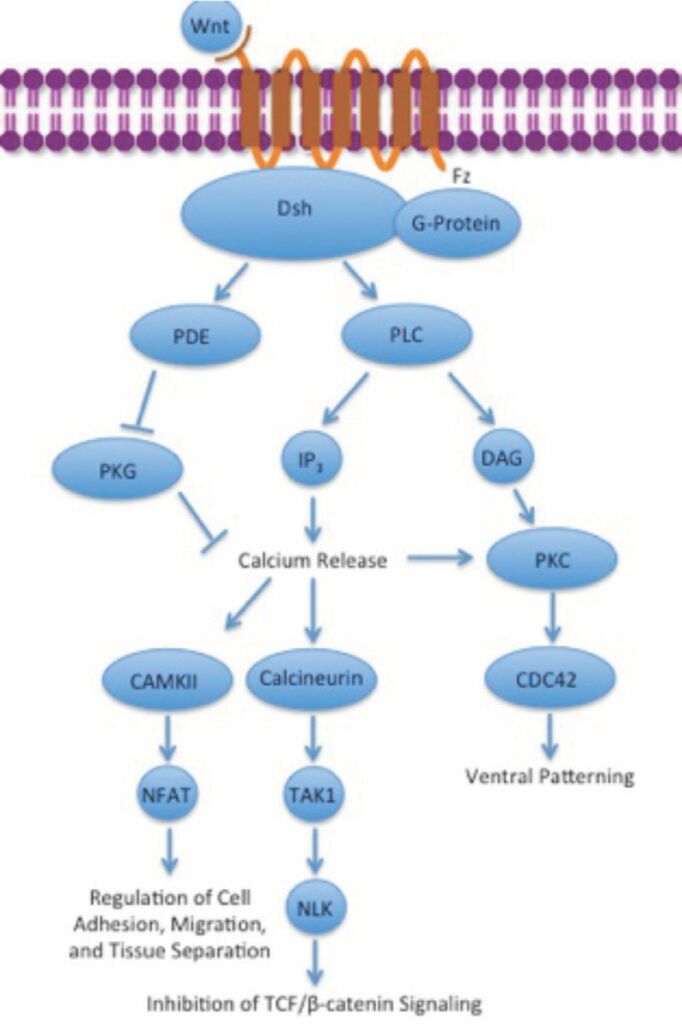
Figura 3. Vía no canónica Wnt / calcio
Fuente: https://www.wikiwand.com/es/Se%C3%B1alizaci%C3%B3n_paracrina
9. Respuestas celulares inducidas
Desarrollo embriónico
La señalización Wnt juega un papel fundamental en el desarrollo embrionario en vertebrados e invertebrados, incluidos humanos. Se lo encontró en la polaridad del segmento de Drosophila, donde ayuda a establecer las polaridades anterior y posterior. Está implicado en otros procesos de desarrollo como formación del eje del cuerpo, particularmente los ejes anteroposterior y dorsoventral. Interviene en la inducción de diferenciación celular para estimular la formación de órganos importantes como pulmones y ovarios. Wnt asegura aún más el desarrollo de estos tejidos mediante la regulación adecuada de proliferación celular y migración (17).
Las funciones de señalización de Wnt se pueden dividir en patrones de ejes, especificación del destino celular, proliferación celular y migración celular.
Patrones de ejes
En el desarrollo embrionario, la formación de los ejes primarios: anteroposterior, dorsoventral y el derecho-izquierdo es crucial para establecer el plan corporal general del organismo. La señalización Wnt está implicada en la formación de los ejes anteroposterior y dorsoventral. La actividad de señalización de Wnt en el desarrollo anteroposterior se puede observar en mamíferos, peces y ranas. Estas proteínas forman gradientes de concentración. Las áreas de mayor concentración establecen la región posterior, mientras que las áreas de menor concentración indican la región anterior.
La señalización Wnt también está involucrada en la formación de ejes de partes específicas del cuerpo y sistemas de órganos. Por ejemplo: el eje dorsoventral del sistema nervioso central; también, guían los axones de la médula espinal en dirección anteroposterior y ayudan a producir el patrón dorsal del miembro en desarrollo (17).
Se involucra en la diferenciación embrionaria: interviniendo en la señalización de las células competentes listas para diferenciarse.
Especificación del destino de la celda
Es un proceso en el que las células indiferenciadas pueden convertirse en un tipo celular más especializado. La señalización Wnt induce la diferenciación de células madre pluripotentes del mesodermo y endodermo diferenciándose en linajes endoteliales, cardíacos y de músculo liso vascular (18) por ejemplo, Wnt3 conduce a células comprometidas con mesodermo con hematopoyético potencial y Wnt1 antagoniza la diferenciación neural y es un factor importante en la autorrenovación de las células madre neurales también involucrada en el desarrollo folículo capilar, desarrollo del tejido pulmonar, diferenciación de células tronco de la cresta neural, desarrollo del nefrón, desarrollo de ovario y determinación del sexo. Antagoniza la formación del corazón, y se demostró que la inhibición de Wnt es un inductor crítico del tejido cardíaco durante el desarrollo (19) y los inhibidores de Wnt de molécula pequeña se usan de forma rutinaria para producir cardiomiocitos a partir de células madre pluripotentes (20).
Proliferación celular
La proliferación y el crecimiento de las células madre es necesaria para la diferenciación masiva de células necesarias para formar los tejidos celulares especificados de diferentes organismos.
Este proceso está mediado por la señalización canónica de Wnt, que aumenta la β-catenina nuclear y citoplasmática. El aumento de β-catenina puede iniciar la activación transcripcional de proteínas como ciclina D1 y c-myc, que controlan el G1 a Fase S transición en el ciclo celular. La entrada en la fase S provoca Replicación de ADN y últimamente mitosis, que son responsables de la proliferación celular (21).
Todo esto es evidente en sistemas como el sistema circulatorio donde Wnt3a conduce a la proliferación y expansión de las células madre hematopoyéticas necesarias para la formación de glóbulos rojos (22).
Las células madre cancerosas son adictas al Wnt, secuestran y dependen de la estimulación constante de la vía Wnt para promover su crecimiento, supervivencia y migración incontrolados, la señalización Wnt puede volverse independiente de los estímulos regulares, a través de mutaciones en oncogenes posteriores y genes supresores de tumores que se activan permanentemente, aunque el receptor normal no haya recibido una señal. La β-catenina se une a factores de transcripción como la proteína TCF4 y en combinación, las moléculas activan los genes necesarios. LF3 inhibe fuertemente esta unión in vitro, en líneas celulares y crecimiento tumoral reducido en modelos de ratón. Evitó la replicación y redujo su capacidad para migrar, todo sin afectar a las células sanas. El descubrimiento fue producto de “diseño racional de medicamentos”, que involucra tecnologías AlphaScreens y ELISA (23).
Migración celular
La señalización tanto de la vía Wnt PCP como de la vía Wnt canónica ayudan a mediar la migración celular durante el desarrollo embrionario, principalmente la extensión durante la gastrulación. Además, está regulada adicionalmente por la vía Wnt / calcio, que la bloquea cuando se activa. También induce la migración celular en etapas posteriores del desarrollo a través del control del comportamiento de migración de neuroblastos, cresta neural células, miocitos y células traqueales (24).
La señalización Wnt está involucrada en el proceso de migración: transición epitelio-mesenquimal (EMT), el cual permite que las células epiteliales se transformen en células mesenquimales, el cual implica la regulación a la baja de cadherina para que las células puedan desprenderse de la laminina y migrar. Es un inductor de EMT, particularmente en el desarrollo mamario (25).

Figura 4. Transición Epitelio-Mesénquima, donde las células pierden polaridad y adherencia y ganan habilidades migratorias.
Fuente: https://es.wikipedia.org/wiki/Transicion_epitelio-mesenquima
10. Discusión
En primer lugar, la β-catenina tiene una función esencial para la formación de placodas capilares durante la embriogénesis. En segundo lugar, se requiere β-catenina para la diferenciación de las células madre de la piel en el adulto. En ausencia de β-catenina, estas células madre no pueden adoptar el destino de los queratinocitos del cabello y, en cambio, se diferencian en queratinocitos epidérmicos.
Sin embargo, la β-catenina puede no ser suficiente para inducir la diferenciación folicular de los queratinocitos, ya que pueden requerirse señales mesenquimatosas adicionales. Experimentos previos han demostrado que la sobreexpresión de una forma estabilizada de β-catenina indujo la formación de novo de folículos pilosos, pero no alteró notablemente la diferenciación epidérmica. Por lo tanto, la evidencia experimental disponible apunta hacia un papel de la β-catenina en el control de la diferenciación de células madre (Figura 5) (26).

Figura 5. Esquema de las posibles funciones de la β-catenina en la morfogénesis del folículo piloso y la diferenciación de células madre de la piel.
(a) Se muestra la ubicación genética de la β-catenina en la interacción ordenada de varias vías de señalización mediadas por FGF, Downless, BMP y SHH.
(b) Se muestra el papel putativo de la β-catenina en la decisión del destino de las células madre del bulto entre los linajes de queratinocitos epidérmicos o foliculares
Fuente: https://www.sciencedirect.com/science/article
Se sabía que las células madre de la piel se diferenciaban en varios linajes, entre ellos la epidermis y el cabello. El hecho de que se esté estudiando e identificado una señal de especificación para el folículo piloso no solo aumenta nuestro conocimiento sobre el desarrollo y la función de la piel, sino que puede considerarse como un avance general en la biología de las células madre.
Las células madre son células pluripotentes que pueden adoptar varios destinos celulares. Cuando se exponen a factores de crecimiento y citoquinas, las células madre pueden generar progenitores, que transitoriamente se amplifican y luego se retiran del ciclo celular para diferenciarse terminalmente, algunos datos indican un papel de la β-catenina en la diferenciación de las células madre de la piel, donde podría colaborar con LEF-1 y/o TCF-3. Por lo tanto, la función de la señalización de β-catenina/Wnt en el mantenimiento y la diferenciación de las células madre merece atención (26).
11. Conclusiones
La supervivencia de un paciente con quemaduras extensas, se limita principalmente al manejo inicial que se le da en las primeras 48 horas; el segundo plano se enfoca en el tratamiento posterior que ofrece la regeneración de la piel definitiva, ya sea, el injerto, colgajo de piel o la terapia celular con células madre, teniendo como objetivo obtener una buena funcionalidad y un resultado estético decente para el paciente, Varios investigadores y algunos laboratorios han desarrollado moléculas que aplicadas sobre las heridas en ratas y algunos pocos en humanos, han obtenido resultados muy alentadores, obteniendo, menor tiempo de epitelización, mejor distribución de melanocitos y menor cicatriz hipertrófica.
Actualmente, no existe ningún sustituto de piel capaz de reemplazar todas las funciones de la piel intacta; sin embargo, el interés y el desarrollo de nuevos métodos terapéuticos incitan al área de investigación a continuar en la búsqueda de la mejor alternativa.
Las características de las células madre de autorrenovarse y para dar origen a diferentes tipos celulares, junto con el desarrollo asombroso de la bioingeniería, plantean un horizonte de posibilidades apasionante. Las células madre epidérmicas tienen un atractivo especial, por su número relativamente elevado, proporcional a la superficie corporal, y su accesibilidad. Aunque de momento se trate de técnicas complejas y con un coste elevado, es probable que en los próximos años los conocimientos sobre la biología de las células madre, así como la seguridad de las técnicas utilizadas, se incrementen, permitiendo que su aplicación se generalice en medicina.
12. Bibliografia


