Outstanding aspects of the face transplantation
Autor
Dr. Jorge Orlando Guerrissi
Ex Jefe de la División de Cirugía plástica del Hosp. Cosme Argerich de CABA, Argentina.
Ex Director de la Carrera de Médico Especialista en Cirugía plástica de la UBA, Argentina.Docente Autorizado de la UBA, Argentina.
Dirección postal:
Libertad 985 Quilmes (Prov. de Buenos Aires) CP: 1878 Argentina.
joguerrissi@gmail.com
Celular: +5491144142656
No existe conflicto de interés económico.
Resumen
El alotrasplante facial (ATF) constituye un recurso terapéutico probadamente confiable. Sobre la base de los avances en inmunología, control del rechazo e infecciones, sumados a la experiencia exitosa de numerosos trasplantes de órganos sólidos se inicia la era de los alotrasplantes de tejidos compuestos que comprenden un grupo heterogéneo de tejidos que incluyen piel, tejido celular subcutáneo, músculo, nervios, cartílagos y huesos.
El alotrasplante de cara (ATF) debe ser considerado un trasplante de tejidos compuestos, anatómicamente diferentes con características histológicas, funcionalidad y capacidad antigénica también diferentes, con una mayor agresividad inmunogénica principalmente por la piel y las mucosas oral y nasal.
El primer alotrasplante facial parcial se realizó en 2005, en Francia, por el equipo del Dr. Dubernard e incluyó nariz, labios y mentón. Los motivos, para hacer un (ATF) han sido traumas en el 68% de los casos, enfermedades congénitas (neurofibromatosis) en el 7,9 %; secuelas por quemaduras en el 21,3% y post resecciones tumorales en el 3,8%.
La concepción razonable para configurar un ATF nace desde la idea de considerar la cara “como un órgano” formado por muchos tejidos cuyas severas disfuncionalidades anatómicas y funcionales no pueden ser corregidas con las técnicas reconstructivas convencionales. Las etapas organizativas de un trasplante facial son similares a la de los de órganos sólidos y se relacionan con el pretrasplante, trasplante y postrasplante. La selección del receptor es tan importante como la del dador y la pesquisa de las contraindicaciones es fundamental. En nuestro país el INCUCAI es el organismo nacional responsable de coordinar la actividad de procuración de órganos y tejidos en la Argentina y fiscaliza el cumplimiento de lo establecido en la ley 24.193 (ley de trasplante de órganos y tejidos).
Lo ideal es que el equipo ablacionista extraiga la pieza del cadáver y en simultáneo otro equipo comience la preparación del lecho receptor, con la intención de minimizar el tiempo de isquemia. Realizado el trasplante quirúrgico, en el que se debe cumplir un algoritmo técnico, el control inmediato de la vitalidad del implante mediante la clínica y la aparatología es fundamental, sin olvidar el rechazo inmunológico agudo cuyo tratamiento depende del uso de corticoides. El éxito no solo está asociado con la excelencia de la técnica quirúrgica, sino con la efectividad de las drogas de inmunosupresión y el manejo ético que involucra a esta reconstrucción en todas las etapas y a todos los que de alguna manera, permanecen involucrados. La experiencia hasta el momento ha demostrado la efectividad y factibilidad de este tipo de trasplante mostrando la aceptación por la mayoría de los pacientes.
Palabras clave: Alotrasplantes. Alotrasplante facial. Trasplante de tejido compuesto.
Summary
Allotransplant facial (ATF) constitutes a proven therapeutic resource. Based in advances in immunology, rejection control and infections, added to the successful experience of numerous solid organ transplants, the era of composite tissue allotransplants comprising a heterogeneous group of tissues including skin, subcutaneous cellular tissue, muscle, nerves, cartilage and bones begins.
Allotransplant of face (ATF) must be considered a transplant of compound tissues, anatomically different with histological characteristics, functionally and antigenic capacity also different,with a greater immunogenic aggressiveness mainly by the skin and the oral and nasal mucous membranes.
The first partial allotransplant facial was performed in 2005, in France, by Dr. Dubernard’s team and included nose, lips and chin. The reasons for doing a (ATF) have been traumas in 68% of cases, congenital diseases (neurofibromatosis) in 7.9%, sequelae due to burns in 21.3% and post tumor resections in 3.8%.
The reasonable conception to configure an ATF is born from the idea of considering the face “as an organ” formed by many tissues whose severe anatomical and functional dysfunctions cannot be corrected with conventional reconstructive techniques. The organizational stages of a facial transplant are similar to those of solid organs and are related to pre-transplantation, transplantation and post-transplantation. The selection of the recipient is as important as that of the giver and the investigation of contraindications is fundamental. In our country, INCUCAI is the national body responsible for coordinating the activity of organ and tissue procurement in argentina and supervises compliance with the provisions of Law 24,193 (Law on Organ and Tissue Transplantation).
Ideally, the ablationist team should remove the body piece and simultaneously another team should begin the preparation of the receiving bed, with the intention of minimizing the time of ischemia. Once the surgical transplant has been performed in which a technical algorithm must be complied with, the immediate control of the vitality of the implant through the clinic and the appliances is fundamental, without forgetting the acute immunological rejection whose treatment depends on the use of corticosteroids. Success is not only associated with the excellence of the surgical technique, but whit the effectiveness of immunosuppressive drugs and the ethical management that involves this reconstruction at all stages and all those who in some way, remain involved. Experience so far has shown the effectiveness and feasibility of this type of transplant showing acceptance by most patients.
Key words: Allotransplant . Face transplantation. Composite tissue transplant.
Introducción
El trasplante de órganos sólidos se ha transformado en una técnica esencial para la continuación de la vida y ha salvado la de millones de personas desde que J. Murray en EEUU en 1954, realizó el primer trasplante exitoso de riñón, en gemelos univitelinos (1). Constituye un recurso terapéutico probadamente confiable. Sin embargo, ha generado una constante discusión en los círculos científicos, biomédicos, mundo legislativo, religioso y en toda la sociedad.
”La bioética comprende un complejo campo de reflexiones filosóficas en torno a la Medicina y las Ciencias Biomédicas, un campo en el que las cuestiones morales y epistemológicas interactúan y se encuentran íntimamente ligadas a materias de preocupaciones prácticas en el cuidado de la salud humana”, este pensamiento de T. Engelhardt resume el grado de complejidad bioética a nivel trasplantológico (2). Los nuevos dilemas éticos generan innumerables respuestas a problemas inéditos.
La realización de un trasplante debe ser benefícente no sólo para con los pacientes sino además de manera justa y responsable con la sociedad. Debe ser llevado a cabo con la más elevada calidad técnica y humana en todas y cada una de las etapas; desde el tratamiento a los pacientes al diagnóstico de la muerte cerebral, la información a las familias, la solicitud del consentimiento familiar, el respeto al cuerpo del cadáver y el anonimato y la confidencialidad de los datos, la elaboración y el cumplimiento estricto de los criterios de selección de donantes y receptores.
Reseña histórica
Desde temprano en la historia de la cirugía moderna, se conoció de experimentos para trasplantar segmentos u órganos enteros.
Para reemplazar órganos en falla. En 1902, Alexis Carrel premio Nobel de Medicina de 1912, publicó su técnica de anastomosis vasculares y trasplante, generando posibilidades factibles para este tipo de procedimientos.
El Profesor Jaboulay realizó los dos primeros trasplantes renales en humanos en 1906 (sin éxito), al injertar riñones de cerdo y oveja en el brazo de dos nefrópatas crónicos terminales. En 1933, el cirujano ruso Yuri Voronoy realiza el primer trasplante renal en una mujer de 60 años en coma urémico por intoxicación por mercurio; sobrevivió 4 días, pero en completa anuria. Seis trasplantes posteriores resultaron sin éxito por el fenómeno de rechazo (3). El 23 de Diciembre de 1954 en el hospital Peter Bent Brigham, de Boston, EE.UU., el equipo liderado por el Dr. Joseph Murray (cirujano plástico) realizó el primer trasplante renal exitoso con donante vivo entre dos gemelos idénticos univitelinos, con lo cual se obvió, el problema del rechazo; el receptor sobrevivió 7 años falleciendo de un infarto cardiaco. Este hito impulsó el trasplante renal entre gemelos, llevándose a cabo sólo en Boston, siete trasplantes similares en los tres años siguientes. El Dr. Murray recibiría el Premio Nobel de Medicina y Fisiología en el año 1990 (4) (Fig. 1).
 Fig.1. Joseph Edward Murray (1919-2012) cirujano plástico y profesor de cirugía de la Escuela de Medicina de Harvard. Realizó el primer trasplante de riñón con éxito en 1954 en gemelos univitelinos y recibió el premio Nobel en 1990.
Fig.1. Joseph Edward Murray (1919-2012) cirujano plástico y profesor de cirugía de la Escuela de Medicina de Harvard. Realizó el primer trasplante de riñón con éxito en 1954 en gemelos univitelinos y recibió el premio Nobel en 1990.
Otro gran avance lo constituyó desde 1961, el uso de azatioprina, un derivado imidazólico de la 6-Mercaptopurina y la aparición de la prednisolona, como medicación antirechazo.
Pero el gran avance ocurrió en 1972 con el descubrimiento de la ciclosporina A, demostrando su elevada eficacia en la prevención del rechazo. La eficacia de la ciclosporina fue uno de los hechos que permitió el desarrollo de trasplantes de otros órganos como corazón, hígado, páncreas, pulmón e intestino.
El descubrimiento del sistema de Antígenos de Leucocitos Humanos – HLA (siglas en inglés) que forma parte del complejo mayor de histo-compatibilidad, permitió en el año 1967 definir la geno-tipificación para elegir el mayor grado de compatibilidad inmunológica entre el receptor y el órgano ajeno a implantar.
El primer trasplante hepático en humanos lo realizó en 1963, el Dr. Thomas E. Starzl en la ciudad de Denver, Colorado, EE.UU., en un infante afectado por falla hepática debida a atresia de vía biliar, pero con muerte a las pocas horas por hemorragia; el primer trasplante de corazón lo realizó en 1967 en Capetown, Sudáfrica, el Dr. Christian Barnard. El primer trasplante de pulmón por James Hardy en 1963, el trasplante combinado de páncreas-riñón por William Kelly en 1966 y el trasplante combinado corazón-pulmón en 1968 por Denton Cooley (ver Bibliog Nº 4).
Material y Método
Sobre la base de los avances en inmunología, control del rechazo e infecciones, sumados a la experiencia y éxito de numerosos trasplantes de órganos sólidos, en 1998 se realizó el primer trasplante exitoso de tejidos compuestos (ATC, Alotrasplante de Tejido Compuesto) (5) (6).
A diferencia del trasplante de órganos sólidos, los ATC comprenden un grupo heterogéneo de tejidos que incluyen piel, tejido celular subcutáneo, músculo, nervios, cartílagos y huesos, cada uno de ellos con su particular función y antigenicidad (7) (8).
Se debe considerar al alotrasplante de cara (ATF) un trasplante de tejidos compuestos (9). Todos ellos son anatómicamente diferentes con características histológicas, funcionalidad y capacidad antigénica también diferentes con una mayor agresividad inmunogénica determinando en el receptor una respuesta más potente que en el trasplante de órganos sólidos, principalmente por la piel y las mucosas oral, nasal y sinusal. Entre los hechos médicos-quirúrgicos que motivaron a los cirujanos a pensar que era posible (ATF) dos son los más importantes: la realización exitosa del primer trasplante de mano en Francia, en 1998 (ver Bibliog. Nº 6) y la pérdida completa de la cara de una niña, por un traumatismo, en la India, seguida de un reimplante exitoso convirtiéndose en el primer autotrasplante de cara (10). El primer alotrasplante facial parcial se realizó en 2005, en Francia, por el equipo del Dr. Dubernard e incluyó nariz, labios y mentón. Hasta el año 2018, se realizaron más de 40 trasplantes parciales y totales de cara en diferentes países como Francia, España, EEUU, China, Turquía, etc. (Fig.2).
 Fig. 2. Primer trasplante parcial de cara realizada por el Dr Dubernard y equipo a una paciente que recibió el ataque de un perro. (Figuras extraídas del libro de Maria Z. Siemionow The know-how of face transplantation, 2011).
Fig. 2. Primer trasplante parcial de cara realizada por el Dr Dubernard y equipo a una paciente que recibió el ataque de un perro. (Figuras extraídas del libro de Maria Z. Siemionow The know-how of face transplantation, 2011).
En 2008 en los Estados Unidos, a cargo de la Dra. Siemionow, se realizó el primer trasplante casi total que incluyó nariz, párpado inferior, labio superior, piso de órbita, maxilar superior, cigoma, paladar, dientes y parótida (11). En el año 2010, el equipo del Dr. Barret realizó en Valencia, España, lo que se podría considerar como el primer trasplante total de cara verdadero, extendido desde la línea de implantación capilar hasta el cuello y de oreja a oreja. También incluyó ambos párpados, boca, paladar duro, mucosa yugal, arcada dentaria superior e inferior junto con la mandíbula. La recuperación fue muy buena. Y el uso de corticoides fue muy eficaz en el tratamiento de episodios de rechazo agudo (12).
Los motivos, para hacer un (ATF) han sido traumas en el 68% de los casos, enfermedades congénitas (neurofibromatosis) en el 7,9 %; secuelas por quemaduras en el 21,3% y post resecciones tumorales en el 3,8%.
Discusión
La concepción básica y razonable para configurar un ATF nace de considerar a la cara “como un órgano” formado por muchos tejidos que cumplen funciones: estéticas, fisiológicas, expresivas y formación de identidad (13).
La finalidad de una compleja reconstrucción facial es conseguir la normalidad en la apariencia del rostro, recuperar la sensibilidad sensitiva, la motilidad de los músculos de la mímica y principalmente restaurar la funcionalidad de los tejidos que intervienen en sentidos tan diferentes como la visión (motilidad palpebral), olfacción y respiración nasal y motilidad de ambos labios.
La racionalidad quirúrgica que debe imperar cuando se decide hacer un trasplante de cara en un paciente severamente afectado, es aquella que muestra que previamente se han agotado todas las instancias reconstructivas convencionales y que las mismas no han podido corregir las disfuncionalidades básicas y presentan discapacidades severas funcionales (14) (Fig. 3 A y B).
 Fig. 3. Katie Stubblefield que por intento de suicidio, a los 18 años de edad, resulta con una severa deformidad facial y recibe un ATF en el año 2017 en USA ( Foto B), luego de varios intentos reconstructivos convencionales (Foto A). (Extraído del diario El País de España, del 18 de agosto de 2018).
Fig. 3. Katie Stubblefield que por intento de suicidio, a los 18 años de edad, resulta con una severa deformidad facial y recibe un ATF en el año 2017 en USA ( Foto B), luego de varios intentos reconstructivos convencionales (Foto A). (Extraído del diario El País de España, del 18 de agosto de 2018).
Sin embargo, en muchos casos con lesión facial severa, el uso de técnicas convencionales reconstructivas permite obtener excelentes resultados (Fig. 4 A y B) (Fig. 5 A y B) .
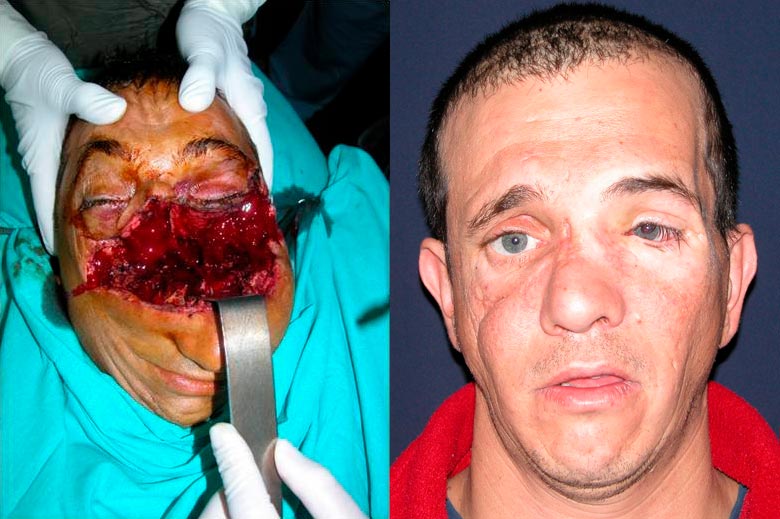 Fig.4. A y B. Pre y postoperatorio de severo trauma facial con excelente resultado estético y funcional con las técnicas convencionales de reparación.
Fig.4. A y B. Pre y postoperatorio de severo trauma facial con excelente resultado estético y funcional con las técnicas convencionales de reparación.
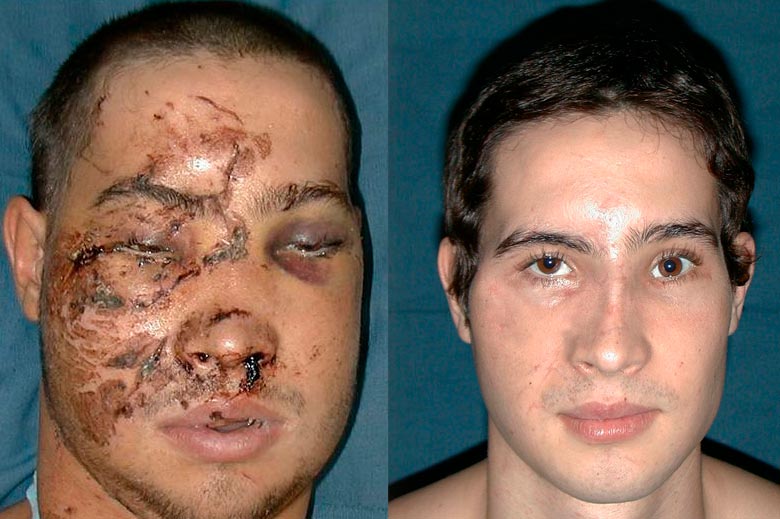 Fig. 5. A y B. Secuela de traumatismo facial con severas fracturas múltiples y lesiones en la piel. No obstante la existencia intacta de la piel y de los músculos hizo factible la reparación exitosa con técnicas quirúrgicas convencionales.
Fig. 5. A y B. Secuela de traumatismo facial con severas fracturas múltiples y lesiones en la piel. No obstante la existencia intacta de la piel y de los músculos hizo factible la reparación exitosa con técnicas quirúrgicas convencionales.
Realizar un trasplante de cara no sólo implica un excelso grado de sapiencia médica-quirúrgica, sino de manifiestos valores éticos, morales y de responsabilidad extremadamente altos por parte de todos los integrantes del equipo médico tratante.
Una consideración muy valiosa es aquella que afirma que la mayoría de estos pacientes están desfigurados pero son sanos y que el trasplante de cara, a diferencia de otros trasplantes, es una situación que no salva la vida, sino que además, puede ponerla en peligro (15).
El primer y principal paso es seleccionar los pacientes que reúnen las condiciones para recibir un trasplante de cara.
Los candidatos ideales son aquellos que presentan defectos de disfuncionalidad severos como las deformidades periorales, perioculares y perinasales (región central de la cara) asociadas a invalidantes deformidades estéticas y que las técnicas standard de reconstrucción plástica son incapaces de recuperar y/o corregir aceptablemente. (Fig.6) y (Fig. 7).
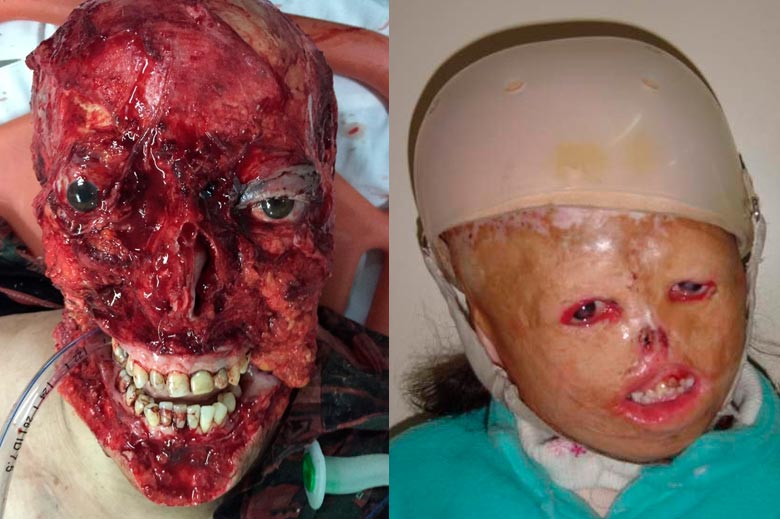
Fig. 6. Paciente que sufrió el arrancamiento de las estructuras blandas de la cara por el ataque de un perro pitbull.
Fig. 7. Nina de 6 años de edad con severas alteraciones funcionales de la cara, como consecuencia de una quemadura grave.
Organización del trasplante
Las etapas organizativas de un trasplante facial son similares a la de los de órganos sólidos y se relacionan con el pretrasplante, trasplante y postrasplante. Lo esencial es seleccionar los pacientes que reúnen las condiciones para recibir un trasplante de cara. Las comorbilidades y el estado general del paciente son muy importantes como también el estado psicológico y de expectativas del paciente y de la familia, la condición social, el grado y nivel de educación.
Etapa pretrasplante: Selección del paciente receptor; evaluación médica, física, psíquica y social. Deben descartarse portadores de tumores malignos, infecciones agudas y/o crónicas. Nefropatías (insuficiencia renal). Alteraciones metabólicas (diabetes, hipercolesterolemia). Cardiopatías. Coagulopatías.
Selección del paciente dador: La pesquisa de contraindicaciones es el pilar fundamental a la hora de aceptar o no al donante de los tejidos. Para ello será necesario llevar adelante una sistemática de evaluación que se inicia como todo acto médico con un exhaustivo control de la historia clínica y un profundo interrogatorio al entorno familiar. Es necesario realizar una serie de estudios complementarios generales y específicos para evaluar la función de cada órgano: 1. Historia clínica; 2. Examen físico; 3.Exámenes de laboratorio; 4. Serología. Evaluar motivo y tiempo de internación y causa de muerte. El interrogatorio al entorno es indirecto a familiares, amigos y convivientes con el objetivo de determinar conductas sociales, antecedentes de drogadicción, HIV, antecedentes de tabaquismo, alcoholismo, patología infecciosa aguda o crónica, neoplasias, cardiopatías y enfermedades arteriales como hipertensión arterial, diabetes. El examen físico debe ser minucioso haciendo hincapié en tatuajes, piercings, lesiones sugestivas de administración por vía endovenosa.
Conocer el estado hemodinámico de las últimas 24 horas, el estado respiratorio, uso de respirador; estado infectológico, hipertermia, focos de infección y tratamiento antibiótico. El fondo de ojo es imprescindible. Los datos de laboratorio deben incluir: hematocrito, recuento de glóbulos blancos, urea, creatininemia, glucemia, ionograma, plaquetas, clearance de creatinina calculado, Hepatograma GOT, GPT, fosfatasa alcalina, Gama GT, LDH. Amilasemia CPK y CPK Mb, Coagulograma completo, Gases en sangre, Estado ácido/base. Sedimento urinario. Test de embarazo en mujeres de edad fértil. Si el paciente estuvo internado por 24 horas realizar urocultivo, hemocultivo, cultivo de secreciones respiratorias .Detección serológica anti HIV, anti VHC, AgHbs, IgM antiHBc, Brucelosis, sífilis, HTLV 1 y 2, CMV, Toxoplasmosis, Chagas. ECG. Rx de tórax y ecografía de abdomen.
Lo ideal es que el donante muera en la terapia intensiva de un hospital.
Consentimiento informado
El paciente deberá saber con gran detalle la envergadura del proceso y sus riesgos. Luego se realizarán los tests y screening pertinentes similares a los de los trasplantes de órganos sólidos. Una vez concluida esta etapa, se podrá considerar al paciente en lista.
Criterios de inclusión y exclusión del donante
Al ser el receptor de un trasplante de cara un paciente sin condiciones que amenazan la vida, los criterios estándares de inclusión para donantes deben ser muy rigurosos Además, a diferencia del trasplante de órganos sólidos, se deben considerar raza, sexo, proporciones del esqueleto facial, color y tono de piel y pelo.
Criterios de inclusión y exclusión del receptor
Inclusión
La historia clínica no demuestra enfermedades coexistentes importantes. Los estudios de laboratorio dentro de los valores normales. La edad ideal entre 15 y 60 años. Condición psicológica acorde con la severidad de la operación y de la rehabilitación postoperatoria.
Exclusión
Infección bacteriana y viral activa. Falla orgánica avanzada; enfermedades del tejido conectivo. Diabetes tipo 1 y tabaquismo severo. Adicciones. CMV. Enfermedad oncológica de menos de 5 años. Imposibilidad de inmunosupresión.
Dada las condiciones sociales, económicas y geográficas cuando se intuye dificultades en el seguimiento y/o rehabilitación postrasplante.
ASA 5
Historia intento de suicidio. Alteración psiquiátrica significativa.
Falla terminal de un órgano.
La tomografía computada y la reconstrucción tridimensional, la angiografía y la electromiografía, entre otros estudios, ayudarán a la identificación de los vasos y nervios recep-tores, así como al planeamiento quirúrgico.
Consideraciones en la ablación
Localizado el dador se deben poner en marcha los protocolos de la preparación del paciente receptor, evaluar las condiciones del dador, preparar los quirófanos donde se hará el implante, teniendo en cuenta las normas y leyes nacionales y locales.
En nuestro país el INCUCAI es el organismo nacional responsable de coordinar la actividad de procuración de órganos y tejidos en la Argentina y fiscaliza el cumplimiento de lo establecido en la ley 24.193 (ley de trasplante de órganos y tejidos).
Comenzar con el equipo ablacionista extrayendo la pieza del cadáver y en simultáneo otro equipo comienza la preparación del lecho receptor, con la intención de minimizar el tiempo de isquemia. Lo ideal es extraer los tejidos faciales antes de los órganos sólidos, porque se mantiene la circulación mientras se los ablaciona y por lo tanto se reduce el tiempo de isquemia caliente (16). Sin embargo, si las condiciones del dador no lo permiten, la obtención de los órganos sólidos tendrá prioridad y se evaluará entonces la suspensión del operativo acorde con las normas y leyes locales y naciona¬les vigentes acerca de la procuración de órganos. Para los distintos grupos de trasplantólogos la situación más aceptada es en aquellos hemodinamicamente estables luego de muerte cerebral; no obstante aceptan que se puede realizar tras paro cardiaco; el tiempo de isquemia no debe superar las 4 horas porque el tejido muscular es muy sensible a la isquemia.
También, de acuerdo con el tipo de injerto que se va a obtener, se evaluará la necesidad de realizar una traqueo¬tomía que facilite esa obtención. Se procederá según protocolo a la medicación y soluciones necesarias para el dador (antibioticoterapia, perfusión con solución de la Universidad de Wisconsin. Algunos autores realizaron irradiación (4 Gy) y otros proceden a obtener médula ósea ya que esta reduciría el riesgo de rechazo crónico, aunque aún no hay estudios confirmatorios.
Trasplante
Según el defecto a reparar, la variedad de tejidos a utilizar (piel, músculos, huesos, dientes, lengua, etc.), las características del injerto, las características de la anatomía del receptor y la estrategia y el algoritmo establecido por el equipo, se debe adaptar la técnica quirúrgica más conveniente. (Tabla I)
Tabla I. Algoritmo en las etapas quirúrgicas Según el defecto a reparar, la variedad de tejidos a utilizar (piel, músculos, huesos, dientes, lengua, etc.) y las características del injerto se debe definir el algoritmo a usar.
Según el defecto a reparar, la variedad de tejidos a utilizar (piel, músculos, huesos, dientes, lengua, etc.) y las características del injerto se debe definir el algoritmo a usar.
Las etapas básicas quirúrgicas son: 1. Reposición parcial de los huesos; 2. Microcirugía arterial si se anastomosan las dos faciales, hacer un lado y soltar el clamp para beneficiar al lado contralateral antes de que sea anastomosado, mediante cruces de vasos hacia el lado opuesto; 3. Microcirugía venosa; 4. Osteosíntesis definitiva de los huesos; 5. Anastomosis nervio facial; 6. Neurorrafia de nervios sensitivos.
En general los pacientes presentan severas alteraciones anatómicas faciales, según la patología que los afecte y seguramente han sufrido varios intentos reconstructivos que han contribuido a alterar aun más la anatomía facial, por lo que debe tenerse en cuenta las dificultades técnicas que puede llevar la implantación del aloinjerto.
Postrasplante
Evaluación del paciente
El grupo quirúrgico, junto con los médicos de terapia intensiva y los médicos clínicos, infectólogos e inmunólogos realizarán el control exhaustivo de la evolución del trasplantado.
Se evaluará la perfusión del injerto mediante Doppler y la oximetría; y también clínicamente controlando el color y la temperatura de los tejidos transferidos, principalmente la piel.
La vigilancia sobre la detección de rechazo, será valorada mediante la realización estricta de las biopsias de la piel y la mucosa oral que se harán semanalmente durante el primer mes, bisemanal en el segundo y tercer mes y luego mensual.
La biopsia de la mucosa muestra más histología de rechazo, pero menos correlación clínica, mientras que la de la piel tiene menos manifestación histológica pero casi siempre se corresponde a la clínica; podría ser que el proceso inflamatorio se produzca por efectos de las drogas y/o infección, lo que sería diferente al rechazo.
La reacción histológica en la mucosa es diferente a la de la piel.
Los tejidos más afectados y con mayor severidad por el rechazo son la piel y la mucosa; los músculos y los huesos son poco afectados. Algunos cirujanos, secundariamente a la resección del bloque facial, realizan la toma de uno o dos colgajos antebraquiales que como col¬gajos centinelas se implantan en la región submamaria o en el hombro o en la región lateral del cuello donde se realizarán las biopsias y la evaluación de rechazo inmunológico.
Para la evaluación recién mencionada se usa la clasificación modificada de Banff (Tabla II)
Tabla II. Clasificación de Bannff  Clasificación internacional para el diagnostico y la categorización de la patología de la biopsia de aloinjerto renal con criterios morfológicos para el diagnóstico y la clasificación del rechazo.
Clasificación internacional para el diagnostico y la categorización de la patología de la biopsia de aloinjerto renal con criterios morfológicos para el diagnóstico y la clasificación del rechazo.
Así como muchas secuelas crónicas pueden presentarse después de grandes reconstrucciones en severas injurias faciales, también pueden ser vistas después de ATF. (Tabla III)
Tabla III. Secuelas crónicas faciales postrasplante
 La magnitud de la cirugía y la extensiva movilización de tejidos puede generar áreas cicatrízales extensas o inadecuada relación tisular generando secuelas crónica y de difícil tratamiento.
La magnitud de la cirugía y la extensiva movilización de tejidos puede generar áreas cicatrízales extensas o inadecuada relación tisular generando secuelas crónica y de difícil tratamiento.
Rehabilitación
Es de vital importancia, tener un equipo interdisciplinario de rehabilitadores para actuar conjuntamente en aspectos psicológicos y del área social.
La rehabilitación facial neuromuscular es fundamental y debe comenzar previa a la cirugía y continuar hasta alcanzar un resultado aceptable por el paciente; cada paciente necesita un tipo de rehabilitación y ejercitación personal.
La disyunción neuromuscular después de ATF puede deberse: 1. Pérdida de la fuerza muscular; 2. Pérdida del control motor aislado, y 3. Hipertonicidad muscular y sincinesias; la función motora facial puede aparecer después de los primeros 3 meses; siempre después de la recuperación de la sensibilidad facial.
La pérdida de la fuerza muscular es una atrofia transitoria y es debida al retardo de la regeneración nerviosa, por lo que es fundamental aplicar técnicas de estimulación, y ejercicios de los músculos afectados.
Muy importante es la recuperación de hablar, deglutir y la expresión facial, los labios juegan un papel importante en estos movimientos. La rehabilitación incluye reeducación de los músculos labiales y perilabiales y el control motor. Los músculos de la sonrisa deben ser ejercitados principalmente mediante ejercicios a través del espejo.
La recuperación de la normalidad de la voz y la pronunciación de letras y palabras es fundamental y debe hacerse una rehabilitación con ejercicios músculo-faciales.
El proceso de la recuperación de la visión es fundamental porque tiene influencia en el área motora, postural, conocimientos, percepción y seguridad.
Es importante mencionar que la reconstrucción quirúrgica puede dejar defectos relacionadas con los dientes, maloclusión, discrepancia de arcos dentarios, comunicaciones oronasal que deben temporariamente ser obturadas con prótesis ideadas para tal fin; la rehabilitación funcional debe asociarse al uso de prótesis para permitir iniciar la misma exitosamente (17).
Es necesario hacer hincapié en la excelencia práctica de la técnica quirúrgica. El equipo trasplantológico debe dominar no solo las técnicas de la cirugía reconstructiva sino además las que corresponden a la cirugía de las patologías de cabeza y cuello. Las técnicas microquirúrgicas de implantación deben ser exquisitamente manejadas. El manejo de los tejidos faciales y la práctica de colgajos locales o de vecindad deben ser conocidos exhaustivamente.
Dependiendo del tipo de tejidos que sean incluidos, la irrigación del aloinjerto puede variar. Los angiosomas faciales sugieren que las anastomosis de múltiples arterias serían necesarias para una adecuada perfusión del completo alotrasplante; sin embargo la experiencia clínica ha demostrado que la piel, la musculatura facial, los tejidos glandulares y el sector anterior del maxilar superior y el malar pueden ser irrigados, solamente con la anastomosis de ambas arterias faciales (18). (Fig. 8)
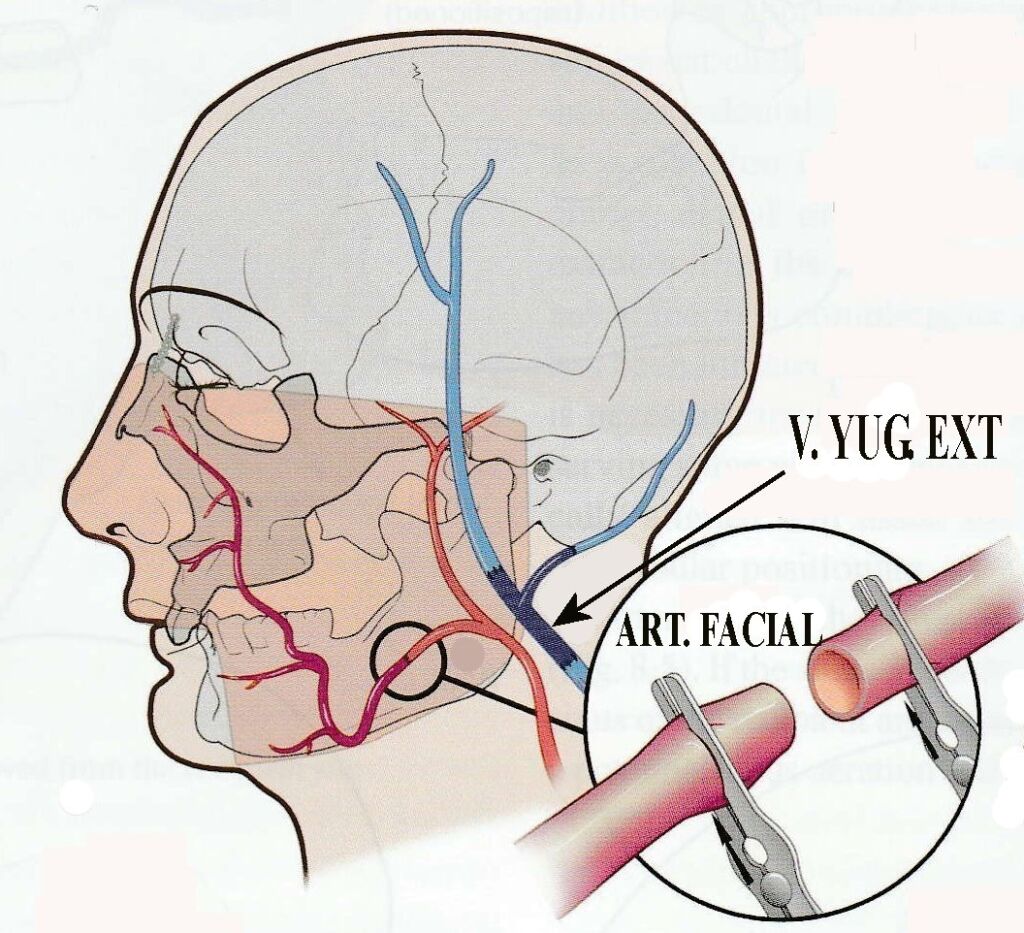 Fig. 8. Anastomosis microquirúrgica de las arterias faciales del dador y el receptor.
Fig. 8. Anastomosis microquirúrgica de las arterias faciales del dador y el receptor.
Según Pomahac (vet Bibliog. Nº 15) el maxilar y el paladar se pueden irrigar por medio de per¬fusión perióstica a partir de las ramas de la arteria facial sin necesidad de anastomosar la arteria maxilar interna (ver Bibliog. Nº 15).
Por otra parte la ligadura de la carótida externa (por encima de la emergencia de la arteria facial), evitaría las excesivas pérdidas sanguíneas durante la realización de las osteotomías tipo Le Fort III.
El estudio angiotomográfico preoperatorio del receptor es elemental porque la causa que genera el trasplante o las frustradas reconstrucciones, pueden haber generado grandes distorsiones de la anatomía y com¬prometer la vasculatura. Cuando los vasos elegidos no están disponibles por trauma y/o cirugías previas, es necesario elegir: 1. Vasos adyacentes a los de la primera elección; 2. Vasos grandes del cuello, carótida externa, vena yugular y 3. Vasos distantes como el tronco tirobicervicofacial.
El éxito del trasplante de cara no solo es la restauración de la piel evitando que “parezca una máscara”; la sensibilidad y el mo¬vimiento son las partes esenciales de la reparación y dependen de la calidad técnica quirúrgica de la reconstrucción a nivel de los músculos y los troncos sensitivos y del nervio facial. (Fig. 9)
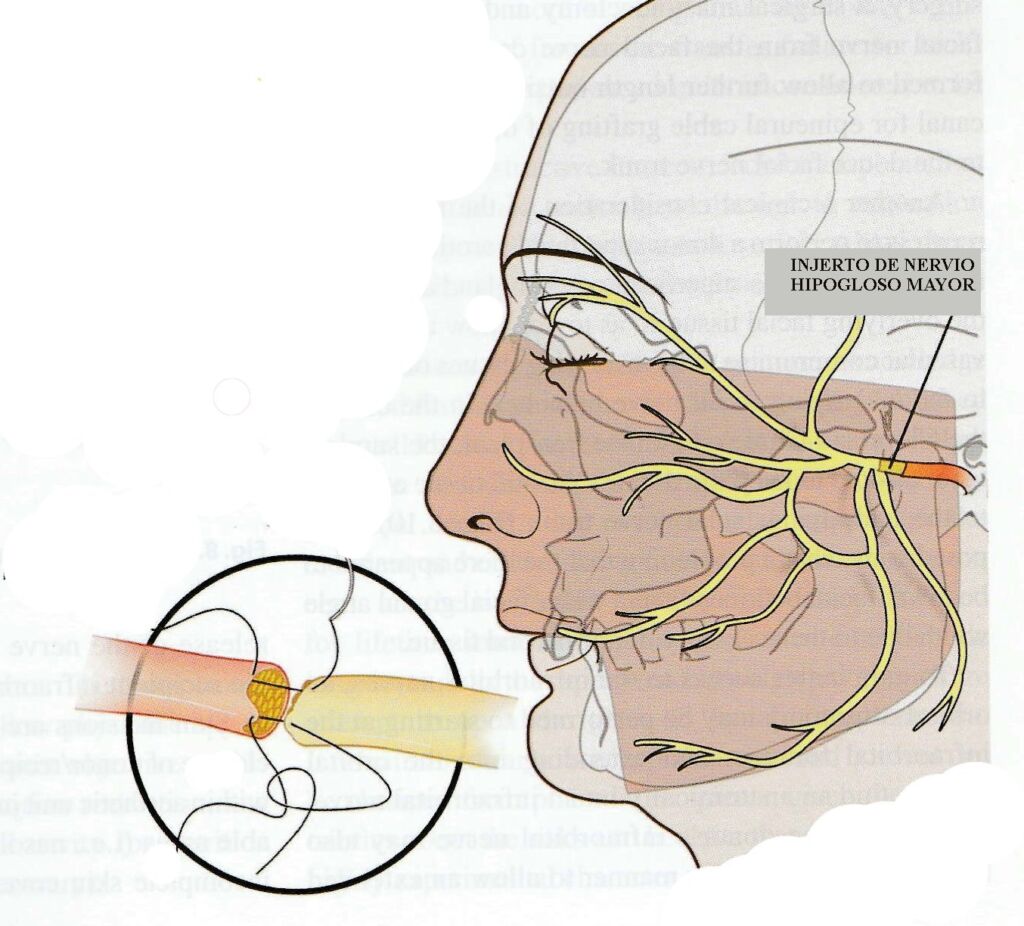 Fig. 9. En la mayoría de los casos realizados fue necesario la reconstrucción del nervio facial del receptor a nivel del tronco mediante la utilización de un injerto libre de nervio, principalmente del nervio hipogloso mayor.
Fig. 9. En la mayoría de los casos realizados fue necesario la reconstrucción del nervio facial del receptor a nivel del tronco mediante la utilización de un injerto libre de nervio, principalmente del nervio hipogloso mayor.
Se considera que la reconstrucción de los nervios supra, infraorbitarios y mentoniano favorecería la recuperación sensitiva, pero la experiencia indica que puede conseguirse sin la neurorrafia mencionada, a través de mecanismos periféricos que se inician en los receptores nerviosos de la piel estimulando el V par, (también estimulado por receptores de la mucosa oral y nasal) y centrales, por el mecanismo de reducción de la representación cortical y expansión de áreas vecinas y contralaterales cuando se desconecta un miembro o parte del cuerpo.
Evaluación ética
Es imprescindible la aplicación de los cuatro principios básicos de la bioética: 1. La justicia: distribución equitativa de las cargas y los beneficios de nuestras acciones; 2. La no maleficencia: obligación de no hacer daño o, si éste es necesario, que sea el mínimo necesario para conseguir el fin propuesto, que debe ser siempre un bien superior al daño causado; 3. La autonomía: obligatorio respeto de las decisiones nacidas de la libre voluntad de las personas, y 4. La beneficencia: compromiso de hacer el bien.
Necesidad de equipo multidisciplinario, así como también establecer leyes y protocolos específicos. Es mandatorio el compromiso del equipo en publicar sus resultados, logros y fracasos y así facilitar el progreso.
Se deberán respetar los principios de la bioética; se deberá respetar la dignidad del donante organizando un equipo que construya una máscar (lo más natural posible), luego de la extracción facial, que permita disminuir el impacto que ocasionará en los familiares del dador cuando se les entrega el cadáver del mismo. Sería conveniente que la información desde el momento de la cirugía, siguiendo con la evolución del trasplantado, sea manejada con un grupo de relacionistas.
Manejo inmunológico
Como se explicó anteriormente, el trasplante de cara inclu¬ye numerosos tejidos y con ellos su peculiar antigenicidad, principalmente de la piel y las mucosas.
El rechazo agudo es inevitable y la experiencia ha demostrado que los episodios acaecidos fueron exitosamente revertidos con corticoides.
Cabe destacar que hasta la actualidad los mecanismos de rechazo crónico están poco definidos. La hipótesis sería la de una alorreactividad huésped versus injerto sub¬clínico que llevaría a la vasculopatía, con la consiguiente hiperplasia intimal, fibrosis y pérdida del injerto (19).
Conclusiones
La cara del ser humano representa una entidad sumamente compleja desde el punto de vista biológico, psicológico y social y el tratamiento de cualquiera alteración anatómica severa es un desafío médico, psicológico, ético y de organización multidisciplinaria.
Las técnicas convencionales de reconstrucción deben ser la primera opción cuando la piel y los músculos se mantienen intactos. Pero en casos severos y extremos, el ATF es una alternativa practicable.
La cara deber ser considerada como un órgano con muchos tejidos que cumplen diferentes funciones y por lo tanto la reconstrucción de la misma no debe atenerse solo a la de cobertura de piel, sino restaurar la funcionalidad de los diferentes sectores de la cara contribuyendo a la recuperación psíquica y de la vida de comunidad; por eso es una de las más complejas reconstrucciones microquirúrgicas.
El éxito de este trasplante no sólo está asociado con la excelencia de la técnica quirúrgica, sino con la efectividad de las drogas de inmunosupresión, la reacción psicológica del paciente trasplantado y el manejo ético que involucra a esta reconstrucción en todas las etapas y a todos los que de alguna manera, permanecen involucrados.
La experiencia hasta el momento ha demostrado la efectividad y factibilidad de este tipo de trasplante mostrando la aceptación por la mayoría de los pacientes. No obstante, el paciente tiene la decisión ética y psicológica de aceptar o no la cirugía, después de haber sido informado de los riesgos y beneficios como también del uso de drogas inmunosupresoras de por vida.
Agradecimiento: Dr. Fortunato Benaim, Miembro de la Academia Argentina de Medicina quien colaboró en la revisión y organización final del trabajo.
Bibliografía
-
Merryl JP, Murray JE, Harrison JH, et al. Successful homotransplantations of the human kidney between identical twins. J Am.Med. Assoc, 1956; 160 (4): 277-282.
-
Engelhardt HT. The ordination of bioethicists as secular moral experts. In Bioethics, EF Paul, FD Miller, J Paul(eds), Cambridge-New York Melbourne,Cambridge UniversityPress, 2002, Pp. 59-82.
-
Matevossian E, Kern H, Hüser N, Doll D, Snopok Y, Nährig J, et al. Surgeon Yurii Voronoy (1895-1961) – a pioneer in the history of clinical transplantation: in memoriam at the 75th anniversary the first human kidney transplantation. Transpl Int. 2009;22 (12): 1132-1139.
-
4. Shackman R. The story of kidney transplantation. Br Med J. 4 June 1966;1(5500): 1379-1383.
-
Petit F, Paraskevas A, Minns AB, et al. Face transplantation: where do we stand? Plast Reconstr Surg. 2004;113(5):1429-1433.
-
Dubernard JM, Owen E, Herzberg G et al. Human hand allograft: report on first 6 months. Lancet. 1999; 353: 1315-1320.
-
Park EE, Genden EM. Facial transplantation: the next frontier in head and. Facial Plast SurgClin North Am. 2009;17(2):271-277.
-
Siemionow MZ, Kulahci Y, Bozkurt M. Composite tissue allotransplantation. PlastReconstr Surg. 2009;124(6 Suppl):e327-339.
-
Siemionow MZ, Klimczak A. Tolerance and future directions for composite tissue allograft transplants: part II. PlastReconstr Surg. 2009;123(1):7e-17e.
-
Pushpakumar SB, Barker JH, Soni CV, et al. Clinical considerations in face transplantation. Burns. 2010;36 (7):951-958.
-
Siemionow MZ, Papay F, Alam D, et al. Near-total human face transplantation for a severely disfigured patient in the USA. Lancet. 2009;374(9685):203-209.
-
Barret JP, Gavaldà J, Bueno J, et al. Full face transplant: the first case report. Ann Surg. 2011;254(2):252-256.
-
Siemionow M, Sommez E. Face as un organ. Ann. Plast. Surg 2008; 61 (13): 345-352.
-
Lantieri L. Face transplant: a paradigm change in facial reconstruction. J Craniofac Surg.2012;23(1):250-253.
-
Pomahac B, Papay F, Bueno EM, et al. Donor facial composite allograft recovery operation: Cleveland and Boston experiences. Plast Reconstr Surg. 2012;129(3):461e-467e.
-
Petit F, Paraskevas A, Minns AB, et al. Face transplantation: where do we stand? Plast Reconstr Surg. 2004;113(5):1429-1433.
-
Leonard DA, Gordon CR, Sachs DH, et al. Immunobiology of face transplantation. J Craniofac Surg. 2012;23(1):268-671.
-
Alam D.S., Papay F., Djohan R , et al. The technical and anatomical aspects of the wordl’s first near-total human face and maxilla transplant. Arch Facial Plast Surg Nov-Dec 2009; 11 (6): 369,377.
-
Whitaker IS, Duggan EM, Alloway RR, et al. Composite tissue allotransplantation: a review of relevant immunological issues for plastic surgeons. J. Plast Reconstr Aesthetic Surg. 2008; 61(5): 481-492.


