Resumen
La infección por SARS-CoV-2 activa el sistema inmune innato que genera una respuesta excesiva, cuando no es efectiva para controlar al virus, este se propagará más rápido y causa mayor daño tisular pulmonar, hiperactivación de macrófagos y granulocitos con liberación masiva de citoquinas proinflamatorias, que se ha denominado síndrome de liberación de citoquinas (CRS, por sus siglas en inglés), que esta asociada al síndrome de insuficiencia respiratoria aguda o Síndrome de Distrés Respiratorio del Adulto (SDRA) que es la principal causa de mortalidad por COVID-19.
El SARS-C o V que ingresa al organismo se une a la enzima convertidora de angiotensina en el sistema renina-angiotensina-aldosterona (ACE2), en los casos graves hay niveles de Angiotensina II muy elevados. La tormenta de citoquinas se relaciona con los 4 grados de severidad de la sintomatología, los más graves son neumonía con hipoxia, que favorece el estado de hipercoagulabilidad.
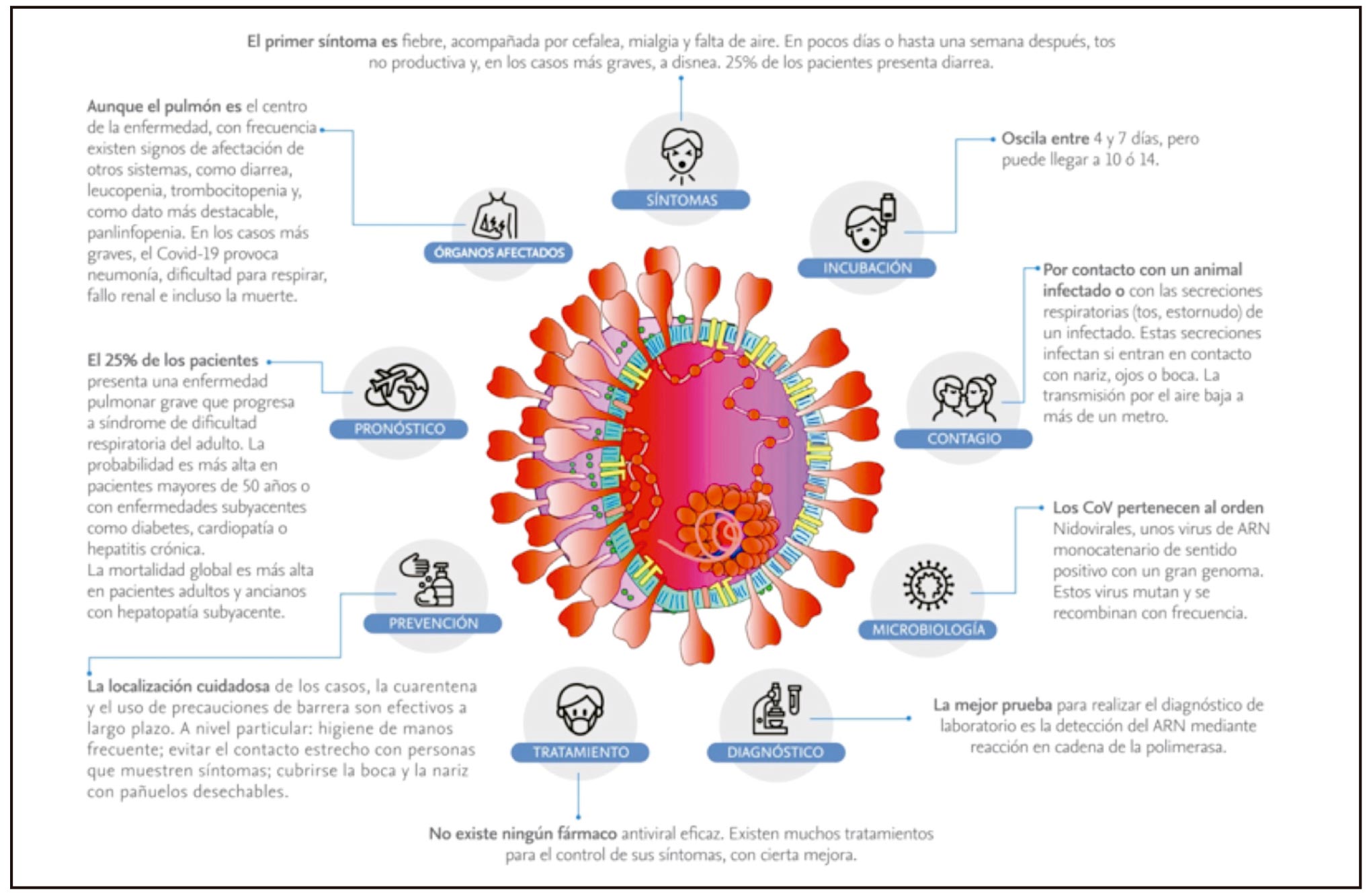
El período de incubación 4-6 días, edad 47 y 56 años, predominio de varones, pocos casos en niños, que suelen ser asintomáticos y sólo presentar alteraciones radiológicas pulmonares. Las Manifestaciones Clínicas son variadas y pueden afectar diferentes órganos y sistemas, al inicio puede presentar fiebre, tos seca, astenia, expectoración, disnea, dolor de garganta, cefalea, mialgia o artralgia, escalofríos, náuseas o vómitos, diarrea, anorexia, dolor abdominal, congestión nasal, diarrea, hemoptisis y congestión conjuntival, visión borrosa, sensación de cuerpo extraño. Otros sintomas: mareo, alteración del nivel de conciencia, accidente cerebrovascular, ataxia, debilidad de las extremidades inferiores y parestesias, neuralgia, arritmia cardíaca, tromboembolismo arterial y venoso, shock y paro cardiogénico, dolor facial, obstrucción nasal, disfunción olfatoria y del gusto, erupciones tipo rash ó urticaria y vesiculas ó púrpura, lesiones acro-cianóticas, hematuria o púrpura trombocitopénica inmune. En hemoglobina disminuye la capacidad para transportar oxígeno y dióxido de carbono.
Palabras clave: Fisiopatología, síntomas, manifestaciones clínicas.
Abstract
SARS-CoV-2 infection activates the innate immune system that generates an excessive response, when it is not effective to control the virus, spreads faster and causes greater lung tissue damage, over activation of macrophages and granulocytes with massive release of pro inflammatory cytokines, which has been called Cytokine Release Syndrome (CRS), which is associated with Acute Respiratory Failure Syndrome or Adult Respiratory Districts Syndrome (ARDS) which is the leading cause of COVID-19 mortality.
The SARS-C or V that enters the body binds to the angiotensin-converting enzyme in the renin-angiotensin-aldosterone system (ACE2), in severe cases there are very controlled levels of Angiotensin II. The cytokine storm is related to the 4 degrees of severity of the symptoms, the most serious being pneumonia with hypoxia, which favors the hypercoagulable state.
The incubation period 4-6 days, age 47 and 56 years, predominance of males few cases in children, who are usually asymptomatic and only present pulmonary radiological alterations. The Clinical Manifestations are varied and can affect different organs and systems at the beginning can present fever, dry cough, asthenia, expectoration, dyspnea, sore throat, headache, myalgia or arthralgia, chills, nausea or vomiting, diarrhea, anorexia, abdominal pain, nasal congestion, diarrhea, hemoptysis and conjunctival congestion, blurred vision, foreign body sensation. Other symptoms: dizziness, altered level of consciousness, stroke, ataxia, weakness of the lower extremities and paresthesias, neuralgia, cardiac arrhythmia, arterial and venous thromboembolism, shock and cardiogenic arrest, facial pain, nasal obstruction, olfactory and taste dysfunction, rash or urticaria rashes and vesicles or purpura, acro-cyanotic lesions, hematuria, or immune thrombocytopenic purpura. In hemoglobin the ability to transport oxygen and carbon dioxide decreases.
Key words: Pathophysiology, symptoms, clinical manifestations.
- Fisiopatología
En la Taxonomía de los virus, los Coronavirus corresponden a la subfamilia de Orthocoronavirinae, que está incluida dentro de la familia Coronaviridae. Se compone de cuatro géneros, según su estructura Genética: Alphacoronavirus, Betacoronavirus, Gammacoronavirus y Deltacoronavirus, El SARS-CoV-2 se clasifica dentro del género Betacoronavirus (1).
- Sistema Inmunitario
La infección por SARS-CoV-2 activa el sistema inmune innato generando una respuesta excesiva que podría estar relacionada con una mayor lesión pulmonar y peor evolución clínica, cuando la repuesta inmune no es capaz de controlar eficazmente el virus, como en personas mayores con un sistema inmune debilitado, el virus se propaga de forma más eficaz produciendo daño tisular pulmonar, lo que activa a los macrófagos y granulocitos con la liberación masiva de citoquinas proinflamatorias.
El circuito de activación de esta vía inmunitaria a partir de la activación de linfocitos T helper (Th) CD4+ y CD8+ aberrantes se produce en pacientes con neumonía por SARS-CoV-2 ingresados en UCI comparados con los no ingresados en UCI, y con controles sanos. Observando una correlación con una mayor proporción de células T CD4+ productoras de IL-6 y GM-CSF (factor estimulante de las colonias de granulocitos-macrófagos con la gravedad de los casos de COVID-19 (2). Otros estudios han observado la presencia de niveles elevados de IL-6 y otras citoquinas proinflamatorias en pacientes con COVID-19 grave (3,4).
Esta hiperactivación resulta insuficiente para controlar la infección y conduce a una depleción linfocitaria asociada a mayor daño tisular, que es observable clínicamente en pacientes graves que presentan linfopenia e hiperferritinemia (5). Esta hiperactivación se ha denominado síndrome de liberación de citoquinas (CRS, por sus siglas en inglés), que estaría asociada al síndrome de insuficiencia respiratoria aguda o Síndrome de Distrés Respiratorio del Adulto (SDRA) que se ha descrito como la principal causa de mortalidad por COVID-19 (6,7).
El CRS se produce cuando se activan grandes cantidades de leucocitos (neutrófilos, macrófagos y mastocitos) y liberan grandes cantidades de citoquinas proinflamatorias (8). El CRS se describió inicialmente como un efecto adverso de terapias con anticuerpos monoclonales, y es frecuente también en las terapias con células CART (células T con receptor de antígeno quimérico. Las principales citoquinas implicadas en la patogénesis del CRS incluyen la interleuquina (IL)-6, la IL10, el interferón (IFN), la proteína quimiotáctica de monocitos 1 (MCP-1) y el factor estimulante de las colonias de granulocitos-macrófagos (GM-CSF); otras citoquinas como el factor de necrosis tumoral (TNF), IL-1, IL-2, IL-2-receptor- e IL-8 también se han descrito durante el CRS. El CRS se ha observado en otras infecciones virales como SARS, MERS o Ébola, aunque a través de la alteración de distintas vías. En pacientes con COVID-19 su patogénesis aún no se conoce totalmente, sin embargo se ha observado una mayor concentración plasmática de varias citoquinas (IL-1β, IL-6, IL2, IL-2R, IL7, IL10, GSCF, IP10, MCP1 MIP1A, TNFα, etc.), fundamentalmente en pacientes con cuadros más graves(9).
- Interacción con el sistema Renina-Angiotensina-Aldosterona
Afinidad por el receptor enzima convertidora de Angiotensina 2. Los coronavirus poseen un genoma de ARN de cadena única, El SARS-C oV que ingresa al organismo se une a la enzima convertidora de angiotensina en el sistema renina-angiotensina-aldosterona(ACE2), que es el receptor funcional para el virus,se encuentran en diferentes células del cuerpo como los neumocitos tipo 2,células inmunes y células dendríticas. Los pacientes que tienen comorbilidades y toman inhibidores del SRAA tienen asociación hacia la severidad de la enfermedad y pueden presentar en su forma más grave el síndrome respiratorio agudo severo.
La Interacción con el sistema renina-angiotensina-aldosterona esta relacionada cuando el virus SARS-CoV-2 penetra en la célula empleando como receptor a la enzima convertidora de angiotensina 2 (ACE-2 por sus siglas en inglés), una exopeptidasa de membarana presente fundamentalmente en el riñón, los pulmones y el corazón. La función de la ACE2 es la trasformación de la Angiotensina I en Angiotensina 1-9 y de la Angiotensina II en Angiotensina 1-7. Estos productos finales tienen efectos vasodilatadores, antifibrosis, antiinflamatorios y favorecen la natriuresis. Estos efectos, reducen la Presión arterial, contrarregulando la acción de la Angiotensina II. La ACE2 se ha relacionado con la protección frente a la hipertensión, la arteriosclerosis y otros procesos vasculares y pulmonares. En modelos animales se ha visto que la ausencia de ACE2 da lugar a un mayor daño pulmonar en el SDRA y la sobrexpresión del ACE2 protege frente al mismo. Por el contrario, la enzima convertidora de la Angiotensina (ACE), que transforma la Angiotensina I en Angiotensina II, favorece la generación de péptidos secundarios con efecto vasoconstrictor, proinflamatorio y de retención de sodio, que se relacionan con la fisiopatología de la hipertensión arterial. Se ha observado que los casos graves de COVID-19 presentan niveles de Angiotensina II muy elevados. Y el nivel de Angiotensina II se ha correlacionado con la carga viral de SARS-CoV-2 y el daño pulmonar. Este desequilibrio del sistema renina-angiotensina-aldosterona podría estar en relación con la inhibición de la ACE2 por parte del virus (10,11).
Respuesta inmune y tormenta de citoquinas. Se ha observado la presencia de una serie de citoquinas y quimiocinas elevadas en el plasma de pacientes con COVID-19, como interleucinas, factor estimulante de colonias de granulocitos, factor estimulante de colonia de macrófagos, proteína interferón inducida por gamma, proteína quimiotáctica de monocitos 1, proteína inflamatoria de macrófagos 1-alfa, factor de crecimiento de hepatocitos, IFN-y y factor de necrosis tumoral alfa.
Clínicamente el paciente podrá manifestar sintomatología variada según la etapa en que se encuentre: ETAPA 1: La multiplicación viral da los síntomas de las primeros 7 días,desde rinorrea, estornudos, pérdida del olfato,pérdida del gusto.ETAPA II A: Etapa pulmonar moderada (sin hipoxemia pulmonar). Etapa II B:neumonía gravecon hipoxia grave.
La secreción incontrolada de toda esta cascada proinflamatoria de moléculas, conduce a lesión de los tejidos y apoptosis de las células endoteliales y epiteliales, dañando las barreras pulmonares microvasculares y alveolares provocando fuga vascular y edema alveolar, lo que eventualmente conduce a hipoxia en el cuerpo. Posteriormente, el aumento rápido de las citocinas y quimiocinas atrae muchas células inflamatorias, como neutrófilos y monocitos, esta infiltración excesiva incrementa la inflamación.
Finalmente, la respuesta inmune adaptativa se une a la lucha contra el virus. Las células T CD4 + estimulan a las células B para que produzcan anticuerpos específicos de virus, y las células T CD8 + matan directamente a las células infectadas por virus. Las células T auxiliares producen citocinas proinflamatorias para ayudar a las células defensoras. La inmunidad humoral que incluye complementos como C3a y C5a y anticuerpos también es esencial para combatir la infección viral. El paciente se encontrará clínicamente enETAPA 3 crítica.
- Interacción con la coagulación y el sistema microvascular
La activación excesiva del sistema inmune innato que causa tormentas de citoquinas, ocasiona daño del sistema microvascular y activa el sistema de coagulación e inhibición de la fibrinólisis.
La coagulación intravascular diseminada (CID) conduce a trastornos generalizados de la microcirculación que contribuyen a la situación de falla multiorgánica(12).
Los niveles de antitrombina son menores en casos de COVID-19, y los niveles de dímero D y fibrinógeno son mayores que en población general. La progresión de la gravedad de la enfermedad va ligada a un aumento gradual del dímero D.
Estos hallazgos apoyan la teoría del desarrollo de coagulopatía de consumo en infecciones por SARS-CoV-2, que empeora el pronóstico (13). Aunque el mecanismo no está completamente establecido, hay varias causas que pueden contribuir a este fenómeno. La IL6 desempeña un papel importante en la red de mediadores inflamatorios y puede causar trastornos de la coagulación a través de diversas vías, como la estimulación hepática para la síntesis de trombopoyetina y fibrinógeno, aumento de la expresión del factor de crecimiento endotelial vascular, expresión de los factores tisulares de los monocitos y la activación del sistema de coagulación extrínseco.
La trombina generada a su vez puede inducir al endotelio vascular a producir más IL-6 y otras citoquinas. Las tormentas de citoquinas y los trastornos de la coagulación de este modo se retroalimentan (11,14). El principio del tratamiento con tocilizumab sería inhibir la IL-6 para revertir el efecto de la tormenta de citoquinas y los trastornos de la coagulación asociados (15).
La alteración de las plaquetas puede presentarsepor varias vías: daño indirecto mediante invasión de las células madre hematopoyéticas de la médula ósea o daño directo mediante la activación del complemento (9). La inflamación producida en el pulmón junto con la hipoxia de los casos con neumonía, causa la agregación plaquetaria y la trombosis, con un aumento de consumo de las plaquetas. Todos estos factores contribuyen a desencadenar el estado de hipercoagulabilidad que se observa en los casos de COVID-19 (16).
- Manifestaciones Clínicas
El período de incubación más habitual está entre 4-6 días, aunque podría llegar hasta los 14 días. La mediana de edad de los pacientes está entre 47 y 56 años, con predominio de varones (17). Se han descrito pocos casos en niños, todos con escasos síntomas y buen pronóstico.
2.1 Casos asintomáticos
El 18% de los casos son asintomáticos, estos casos se detectan en el contexto de búsquedas exhaustivas en brotes intrafamiliares donde se realizaron pruebas diagnósticas.
Los casos asintomáticos son más frecuentes en niños y se ha observado que algunos de ellos presentan alteraciones radiológicas pulmonares, como opacidades multifocales y alteraciones analíticas, como la elevación de la fosfatasa (17).
2.2 Síntomas
En China se describieron los síntomas y signos más frecuentes: 55.924 casos confirmados por laboratorio, que incluyen: fiebre (87,9%), tos seca (67,7%), astenia (38,1%), expectoración (33,4%), disnea (18,6 %), dolor de garganta (13,9%), cefalea (13,6%), mialgia o artralgia (14,8%), escalofríos (11,4%), náuseas o vómitos (5 %), congestión nasal (4,8%), diarrea (3,7%), hemoptisis (0,9%) y congestión conjuntival (0,8%) (18).
En Europa, con 14.011 casos confirmados notificados al Sistema Europeo de Vigilancia (TESSy) por 13 países (97% de Alemania), los síntomas más frecuentes fueron: fiebre (47%), tos seca o productiva (25%), dolor de garganta (16%), astenia (6%) y dolor (5%) (18).
En España, con 18.609 casos notificados, los síntomas más frecuentes fueron: Fiebre o reciente historia de fiebre (68,7%), tos (68,1%), dolor de garganta (24,1%), disnea (31%), escalofríos (27%), vómitos (6%), diarrea (14%) y otros síntomas respiratorios (4,5%) (19).
2.2.1 Síntomas relacionados con distintos órganos y sistemas
Neurológicos:
En un estudio con 214 pacientes ingresados en un hospital de Wuhan, el 36% tenían síntomas neurológicos: mareo (17%), alteración del nivel de conciencia (7%), accidente cerebrovascular (2,8%), ataxia (0,5%), epilepsia (0,5%) y neuralgia (2,3%) (20).
También se han descritos casos de síndrome de Guillain-Barré (21).
Cardiológicos:
Se estima que alrededor del 20% de los pacientes con COVID-19 confirmado por la enfermedad puede presentarse con síntomas relacionados en el fallo cardiaco o el daño miocárdico agudo, incluso en ausencia de fiebre y síntomas respiratorios (22).
Se sugieren varios mecanismos que pueden conducir a esto: El primero está relacionado con la expresión de ACE2 en cardiomiocitos. La unión de SARS-CoV-2 a ACE2 podría provocar alteraciones en las vías de señalización relacionadas con ACE2 y, posteriormente, causar inflamación local.
El segundo mecanismo posible es la lesión cardíaca aguda provocada por la tormenta de citoquinas, que se desencadena por un desequilibrio entre las células T auxiliares tipo 1 y tipo 2. En la mayoría de los casos de curso grave de COVID-19, se informaron niveles séricos elevados de citocinas proinflamatorias, incluidas IL-6, IL-1 β, IL-2, IL-8, IL-17, factor estimulante de colonias de granulocitos y macrófagos, proteína quimioatrayente. Como resultado de esta respuesta inflamatoria sistémica, pueden ocurrir no sólo lesiones cardíacas, sino también síndrome de insuficiencia multiorgánica.
Tercer mecanismo posible es el efecto de la inflamación sistémica.Es el aumento del flujo sanguíneo coronario que puede conducir a un infarto de miocardio debido a la rotura de la placa aterosclerótica.
Cuarto mecanismo posible es la hipoxemia como resultado de lesión pulmonar aguda, que conduce a deterioro de la relación miocárdica de la demanda de oxígeno-suministro, estrés oxidativo, acidosis intracelular y finalmente daña las células miocárdicas.
Quinto mecanismo posible es el desequilibrio electrolítico, especialmente la hipocalemia debido a la interacción SARS-CoV-2 con el sistema renina angiotensina-aldosterona.
Los hallazgos patológicos varían desde un cambio mínimo a infiltración inflamatoria intersticial y necrosis. Las manifestaciones clínicas cardiovasculares de covid-19 incluyen elevación de biomarcadores cardíacos, arritmia cardíaca, tromboembolismo arterial y venoso y shock y paro cardiogénico.
Oftalmológicos:
En una serie de 534 pacientes confirmados en Wuhan se detectaron en 20,9% ojo seco, 12,7% visión borrosa, 11,8% sensación de cuerpo extraño y 4,7% congestión conjuntival (el 0,5% la presentaron como primer síntoma) (23).
Otorrinolaringológicos:
Los síntomas más frecuentes son dolor facial, obstrucción nasal, disfunción olfatoria y del gusto (24). La frecuencia con la que presentan la hiposmiaanosmia y la hipogeusia-disgeusia están descritas entre el 5% y el 65% de los casos según las series, siendo en muchos casos el primer síntoma (24,25). La pérdida de gusto y olfato fueron los síntomas que mejor predijeron la enfermedad, entre los referidos por los casos con sospecha de COVID-19 que utilizaron una aplicación de móvil de uso masivo en Reino Unido y EEUU (26). En los resultados preliminares de la encuesta de seroprevalencia en España, con una prevalencia general de 5% (IC95% 4,7-5,4), la prevalencia de las personas que habían tenido anosmia fue 43,3% (IC95% 39,9-46,8) (27).
Dermatológicos:
Se han observado manifestaciones muy variadas, desde erupciones tipo rash (principalmente en el tronco), erupciones urticarianas y vesículas similares a varicela o púrpura. En los dedos de manos y pies lesiones acro-cianóticas parcheadas, de pequeño tamaño, a veces confluentes y en ocasiones con ampollas. Estas lesiones son similares a la perniosis (sabañones) y aparecen con más frecuencia en niños y adolescentes sin otros síntomas (28).
Hematológico:
Se describen mayor incidencia de fenómenos trombóticos asociados a los casos de COVID-19 que se manifiestan como infarto cerebral, isquemia cardiaca, muerte súbita, embolismos, trombosis venosa profunda. También se observa mayor incidencia de sangrados (9).
Renales:
El riñón humano es un objetivo específico para el SARS-CoV-2, se descubrió que los antígenos se acumulaban en los túbulos renales, lo que sugiere que infecta el riñón humano directamente, induciendo lesión renal aguda y contribuyendo a la propagación viral en el cuerpo. Se sugiere que las lesiones renales agudas podrían ser el resultado del síndrome de liberación de citocinas, en lugar de la replicación viral activa en el riñón.Las características clínicas de las complicaciones relacionadas con los riñones incluyen hematuria, proteinuria. Las consecuencias hemodinámicas, proinflamatorias y proapoptóticas de la inflamación pulmonar, el síndrome de liberación de citocinas y la hipercoagulabilidad aumentan el riesgo de lesión renal aguda.
La Insuficiencia renal Aguda (IRA) puede ser común en pacientes con Covid-19, puede ser causada por depleción de volumen, falla multiorgánica,infección viral que conduce directamente a lesión tubular renal, procesos vasculares trombóticos,glomerulonefritis o rabdomiólisis.
Se presenta una patología renal intrínseca que incluye procesos vasculares trombóticos, lesión de células tubulares mediadas por virus, también se han presentado en menos de 1% lesión tubular proximal con Síndrome de Fanconi que se manifiesta con hipopotasemia, hipofosfatemia, acidosis metabólica con anion gap normal e hipovolemia con pérdida de sodio. Su presencia se asocia con riesgo mayor a muerte (17).
Gastrointestinales:
La interacción entre SARS-CoV-2 y ACE2 puede provocar diarrea al encontrarlo en enterocitos, células glandulares gástricas y epitelios duodenales.Los enterocitos que expresan ACE2 son invadidos por SARS-CoV-2, lo que lleva a mala absorción, secreción intestinal desequilibrada y activada del sistema nervioso entérico, que finalmente produce diarrea. En segundo lugar, el SARS-CoV-2 daña indirectamente el sistema digestivo a través de una cadena de respuestas inflamatorias, la flora del tracto digestivo se afecta mutuamente con el tracto respiratorio a través de regulación inmune, el llamado eje intestino-pulmón. La anorexia es el síntoma gastrointestinal más común, seguido de diarrea, náuseas / vómitos y dolor o molestias abdominales y se detectó ARN del virus en muestras de heces, incluso en heces recolectadas después de que las muestras respiratorias dieron negativo.
Hepáticas:
Podría ser causado por efectos citopáticos inducidos por SARS-CoV-2,que se une al receptor de la enzima convertidora de angiotensina 2, e ingresa a las células objetivo para desregular la función hepática.Los linfocitos son importantes para inhibir las respuestas inmunes innatas hiperactivas durante la infección viral. Por lo tanto, la linfopenia típica durante la infección por SARS-CoV-2 puede dar lugar a aumentos en interleucina-6, IL-10, IL-2 y Niveles de IFN-c y respuestas inflamatorias agravadas, que no conducen sólo a la lesión pulmonar, sino también a otros órganos incluido el hígado.
La linfopenia y el nivel de PCR se asociaron con lesión de hígado, lo que sugiere que la tormenta inflamatoria de citoquinas podría ser el mecanismo principal.
Otro posible factor contribuyente puede ser el alto nivel de presión espiratoria final positiva que puede causar congestión hepática aumentando la presión auricular derecha e impidiendo el retorno venoso. El daño hepático en pacientes con infección por SARS-CoV-2 puede no ser causado directamente por una infección viral, sino por la respuesta inflamatoria sistémica causada por medicamentos terapéuticos o neumonía.
Glándula suprarrenal:
Se ha descrito la expresión de ACE2. Se piensa que el virus expresa ciertas secuencias de aminoácidos que actúan como imitadores moleculares de la hormona adrenocorticotrópica del huésped para eliminar la respuesta al estrés del cortisol, abriendo la posibilidad de una hipofisitis reversible o un daño hipotalámico directo que podría conducir a un estado de disfunción hipotálamo-hipofisaria transitoria.
SNC:
Se ha asociado síndrome de Guillain-Barré después del inicio de la enfermedad por el virus con síntomas como debilidad de las extremidades inferiores y parestesias en cuatro pacientes y diplejia facial seguidas de ataxia y parestesias en un paciente.
Endotelial:
También expresa receptores ACE2 y se ha demostrado su participación a través de lechos vasculares de diferentes órganos en una serie de pacientes con COVID-19. Se provoca disfunción endotelial generalizada asociada con la apoptosis, la cual es un determinante principal de la disfunción microvascular al cambiar el equilibrio vascular hacia una mayor vasoconstricción con posterior isquemia orgánica, inflamación con edema tisular asociado y un estado procoagulante. Se sugiere que la infección por SARS-CoV-2 facilita la inducción de endoteliitis en varios órganos como consecuencia directa de la participación viral y de la respuesta inflamatoria del huésped. Además, la inducción de apoptosis y piroptosis podría tener un papel importante en su lesión.
Aparato reproductor masculino:
Se ha descubierto que la hormona luteinizante en suero aumentó significativamente, pero la proporción de testosterona a LH y la proporción de la hormona folículo estimulante a LH disminuyó significativamente. También se informó que ACE2 se expresa altamente en células de Leydig y células en conductos seminíferos en los testículos y el virus podría unirse directamente a dichas células dañando el tejido testicular.
Con esto, aunado a que en hombres se ha retrasado la eliminación viral de SARS-CoV2 en comparación con mujeres, se sugiere que existe un potencial hipogonadismo y se debe prestar atención al efecto del SARS-CoV-2 en el sistema reproductivo. Sin embargo, hay muestras de biopsia testicular que fueron negativas para el SARS-CoV-2, lo que justifica una mayor investigación para explorar si el virus realmente afecta.
Aparato reproductor femenino:
Se sugiere que ACE2 se expresa ampliamente en el ovario, el útero, la vagina y la placenta y existe la posibilidad de transmisión de madre a hijo y sexual. Ang II, ACE2 y Ang- regulan el desarrollo y la ovulación del folículo, modulan la angiogénesis y la degeneración lútea y también influyen en los cambios regulares en el tejido endometrial y el desarrollo embrionario. Teniendo en cuenta estas funciones, 2019-nCoV puede alterar las funciones reproductivas femeninas mediante la regulación de ACE2.
Órganos linfoides:
Induce agotamiento del folículo linfático, la atrofia del nódulo esplénico, la hiperplasia de histiocitos y la reducción de linfocitos. Además, conduce a una apoptosis linfocítica grave y también desencadena macrófagos para producir IL-6, una citocina proinflamatoria que promueve directamente la necrosis linfocitaria. En conjunto, neutralizan directamente el bazo humano y los LN a través de la infección de macrófagos CD169 + residentes en los tejidos.
Hematología y Hemoglobina:
Se ha sugerido que el virus es un factor causal de púrpura trombocitopénica inmune. Una investigación ha mostrado que el ORF8 y una glicoproteína de superficie podrían unirse a la porfirina, respectivamente. Al mismo tiempo, las proteínas orf1ab, ORF10 y ORF3a podrían coordinar el ataque del hem en la cadena 1-beta de la hemoglobina desasociando el hierro para formar la porfirina, disminuyendo su capacidad para transportar oxígeno y dióxido de carbono.
Páncreas:
Se han encontrado pacientes leves y graves con pancreatitis leve con niveles elevados de amilasa y lipasa y ocasionalmente alteraciones en las imágenes.

Bibliografía
- Liu C, et al. Research and Development on Therapeutic Agents and Vaccines for COVID-19 and Related Human Coronavirus Diseases. ACS Cent Sci. 2020. Doi: https://doi.org/10.1021/acscentsci.0c0027.
- Zhou Y, Fu B, Zheng X, Wang D, Zhao C, Qi Y, et al. Aberrant pathogenic GM-CSF+ T cells and inflammatory CD14+CD16+ monocytes in severe pulmonary syndrome patients of a new coronavirus. bioRxiv [Internet]. 20 de febrero de 2020 [citado 17 de abril de 2020];2020.02.12.945576. Disponible en: https://www.biorxiv.org/content/10.1101/2020.02.12.945576v1.
- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet Lond Engl. 24 de enero de 2020; 113.
- Chen L, Liu HG, Liu W, Liu J, Liu K, Shang J, et al. [Analysis of clinical features of 29 patients with 2019 novel coronavirus pneumonia]. Zhonghua Jie He He Hu Xi Za Zhi Zhonghua Jiehe He Huxi Zazhi Chin J TubercRespir Dis. 12 de marzo de 2020;43(3):203-8.
- van der Poll T, van de Veerdonk FL, Scicluna BP, Netea MG. The immunopathology of sepsis and potential therapeutic targets. Nat Rev Immunol. Julio de 2017;17(7):407-20.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet Lond Engl. 11 de marzo de 2020; 117.
- Zhang J-J, Dong X, Cao Y-Y, Yuan Y-D, Yang Y-B, Yan Y-Q, et al. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. 19 de febrero de 2020.
- Lee DW, Gardner R, Porter DL, Louis CU, Ahmed N, Jensen M, et al. Current concepts in the diagnosis and management of cytokine release syndrome. Blood. 10 de julio de 2014;124(2):188-95.
- Mei H, Hu Y. [Characteristics, causes, diagnosis and treatment of coagulation dysfunction in patients with COVID-19]. Zhonghua Xue Ye Xue Za Zhi Zhonghua Xueyexue Zazhi. 5 de marzo de 2020;41(0):E002.
- Garabelli PJ, Modrall JG, Penninger JM, Ferrario CM, Chappell MC. Distinct roles for angiotensin-converting enzyme 2 and carboxypeptidase A in the processing of angiotensins within the murine heart. Exp Physiol. mayo de 2008;93(5):613-21.
- Imai Y, Kuba K, Rao S, Huan Y, Guo F, Guan B, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure. Nature. 7 de julio de 2005;436(7047):112-6.
- Cohen J. The immunopathogenesis of sepsis. Nature. 19 de diciembre de 2002;420(6917):885-91.
- Yin S, Huang M, Li D, Tang N. Difference of coagulation features between severe pneumonia induced by SARS-CoV2 and non-SARS-CoV2. J Thromb Thrombolysis. 3 de abril de 2020.
- Anaka T, Narazaki M, Kishimoto T. Immunotherapeutic implications of IL-6 blockade for cytokine storm. Immunotherapy. 2016;8(8):959-70. 124. Jiang H, Liu L, Guo T, Wu Y, Ai L, Deng J, et al.
- Improving the safety of CAR-T cell therapy by controlling CRS-related coagulopathy. Ann Hematol. julio de 2019;98(7):1721-32.
- Han H, Yang L, Liu R, Liu F, Wu K-L, Li J, et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clin Chem Lab Med. 16 de marzo de 2020.
17.Hu Z, Song C, Xu C, Jin G, Chen Y, Xu X, et al. Clinical characteristics of 24 asymptomatic infections with COVID-19 screened among close contacts in Nanjing, China. Sci China Life Sci. 4 de marzo de 2020.
- World health Organization. Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) [Internet]. 2020.
- Coronavirus disease 2019 (COVID-19) pandemic: increased transmission in the EU/EEA and the UK – seventh update [Internet]. European Center for Disease Control and Prevention; 2020 mar. Disponibleen: https://www.ecdc.europa.eu/sites/default/files/documents/RRAseventh-update-Outbreak-of-coronavirus-disease-COVID-19.pdf.
- Ma S, Zhang J, Zeng M, Yun Q, Guo W, Zheng Y, et al. Epidemiological parameters of coronavirus disease 2019: a pooled analysis of publicly reported individual data of 1155 cases from seven countries. medRxiv [Internet]. 24 de marzo de 2020 [citado 13 de abril de 2020];2020.03.21.20040329. Disponible en: https://www.medrxiv.org/content/10.1101/2020.03.21.20040329v1.
- Mao L, Wang M, Chen S, He Q, Chang J, Hong C, et al. Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study. medRxiv [Internet]. 25 de febrero de 2020 [citado 4 de abril de 2020];2020.02.22.20026500. Disponible en: https://www.medrxiv.org/content/10.1101/2020.02.22.20026500v1.
- Cao-Lormeau V-M, Blake A, Mons S, Lastere S, Roche C, Vanhomwegen J, et al. GuillainBarre Syndrome outbreak associated with Zika virus infection in French Polynesia: a casecontrol study. Lancet Lond Engl. 29 de febrero de 2016.
- Zheng Y-Y, Ma Y-T, Zhang J-Y, Xie X. COVID-19 and the cardiovascular system. Nat Rev Cardiol [Internet]. 5 de marzo de 2020 [citado 16 de marzo de 2020];1-2. Disponibleen: https://www.nature.com/articles/s41569-020-0360-5.
- Ocular manifestations and clinical characteristics of 534 cases of COVID-19 in China: A cross-sectional study | medRxiv [Internet]. [citado 25 de marzo de 2020]. Disponible en: https://www.medrxiv.org/content/10.1101/2020.03.12.20034678v1.
- Lechien JR, Chiesa-Estomba CM, De Siati DR, Horoi M, Le Bon SD, Rodriguez A, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Oto-RhinoLaryngol Off J Eur Fed Oto-Rhino-LaryngolSoc EUFOS AffilGerSoc Oto-Rhino-Laryngol – Head Neck Surg. 6 de abril de 2020.
- Haehner A, Draf J, Draeger S, With K de, Hummel T. Predictive value of sudden olfactory loss in the diagnosis of COVID-19. medRxiv [Internet]. 3 de mayo de 2020 [citado 13 de mayo.
- Menni C, Valdes AM, Freidin MB, Sudre CH, Nguyen LH, Drew DA, et al. Real-time tracking of self-reported symptoms to predict potential COVID-19. Nat Med. 11 de mayo de 2020.
- The Lancet null. COVID-19: protecting health-care workers. Lancet Lond Engl. 21 de 2020;395(10228):922.
- Shedding of infectious SARS-CoV-2 in symptomatic neonates, children and adolescents | medRxiv [Internet]. [citado 13 de mayo de 2020]. Disponible en: https://www.medrxiv.org/content/10.1101/2020.04.27.20076778v1.


