 COVID Pandemic Care Guide for Severe Burns 19. Nutrition of the Pediatric and Adult Patient
COVID Pandemic Care Guide for Severe Burns 19. Nutrition of the Pediatric and Adult Patient
Autores: Tihista S (1), Báez A (2), Prieto S (3), Ugarelli G (4), López S (5)
(1) Serrana Tihista. serranatihista@hotmail.com. +59894800377. Almirón 5504 Apto 8, Montevideo, Uruguay. Código postal 1400
(2) Alicia Báez. alibaya4@hotmail.com.+595981107709 Juan días de Solís 1109. Asunción, Paraguay. Código postal 1109
(3) Sandra Prieto. sampri03@gmail.com +5491163578790. Coronel Bogado 1886, Florida, Vicente López, Buenos Aires, Argentina. Código postal 1602
(4) Gabriela Ugarelli. gabrielaugarelli@hotmail.com+511991760057. Pasaje Carlos Augusto Salaverry 206. Urbanización Los Precursores. Santiago de Surco, Lima, Perú. Código postal 15056
(5) Sandra López. nutriologasandralopez@gmail.com.+524181143994. Hidalgo 80, Centro, Dolores Hidalgo, Guanajuato, México. Código postal37800
Resumen
La terapia nutricional (TN) es parte muy importante del tratamiento del paciente quemado. Se considera que los avances en esta área han disminuido la mortalidad. Sin embargo, no hay consenso generalizado y la TN varía enormemente entre los centros de quemados. La epidemia de COVID – 19 agrega complejidad al cuadro, pues recién están surgiendo evidencias.
Objetivo: Establecer recomendaciones para estandarizar la TN en todos los países de la Federación Iberolatinoamericana de Quemaduras. (FELAQ) en época de COVID – 19.
Metodología: Revisión de las últimas guías existentes y bibliografía surgida con posterioridad a su publicación.
Resultados: Luego de analizar la bibliografía se elaboraron 19 recomendaciones relacionadas al equipo tratante, evaluación nutricional, requerimiento energético, de macro y micronutrientes, vías de nutrición, aspectos de la vía enteral, selección de la dieta enteral, monitoreo y desafío de los servicios de nutrición en la pandemia.
Conclusión: La TN del quemado con o sin COVID- 19 tiene particularidades respecto de la de otros pacientes críticos. Es necesario conocerlas para atenuar el intenso hipermetabolismo y catabolismo, optimizar cicatrización de herida y reducir la morbi-mortalidad. La TN será enteral temprana, alta en proteínas, carbohidratos, elementos traza y baja en grasas. Otros nutrientes están en estudio. Se requiere monitoreo estrecho para alcanzar los objetivos.
Palabras clave: hipermetabolismo, hipercatabolismo, requerimientos de energía y nutrientes, nutrición enteral.
Abstract
Nutritional therapy (TN) is a very important part of the treatment of the burned patient. Advances in this area are believed to decrease mortality. However, there is no general consensus and the TN varies greatly between burn centers. COVID – 19 epidemic adds complexity to the situation, as evidence is just emerging.
Objective: Establish recommendations to standardize TN in all the countries members of the Ibero Latin American Burns Federation (FELAQ) at the time of COVID – 19.
Methodology: Review of the latest existing guides and emerging bibliography.
Results: After analyzing the bibliography, 19 recommendations were made related to the treating team, nutritional evaluation, energy requirement, macro and micronutrients, nutrition routes, aspects of the enteral route, selection of the enteral diet, challenge of nutrition services in the pandemic.
Conclusion: The TN of the burned patients with or without COVID-19, has particularities in respect of other critically ill patients. It is necessary to know them in order to attenuate the intense hypermetabolism and catabolism, optimize wound healing and reduce morbidity-mortality. TN will be early enteral, high in protein, carbohydrates, trace elements and low in fat. Other nutrients are under study. Close monitoring is required to achieve the objectives.
Key words: hypermetabolism, hypercatabolism, energy and nutrient requirements, enteral nutrition.
Antecedentes
La TN es parte fundamental del tratamiento de los quemados y se considera que los avances en esta área han disminuido la mortalidad. Sin embargo, no hay consenso generalizado y la TN varía enormemente entre los centros de quemados. En relación a pacientes quemados infectados con el virus SARS- CoV-2, no hay estudios específicos sobre la mejor TN, por tanto, esta revisión tiene como objetivo proporcionar nueva evidencia sobre la TN de los quemados graves a la luz de experiencia en pacientes críticos y con COVID – 19 (1– 4).
Nos proponemos revisar la literatura reciente y establecer recomendaciones con el objetivo de estandarizar la TN en todos los países de la Federación Iberolatinoamericana de Quemaduras (FELAQ), para beneficio del paciente quemado.
Cambios metabólicos en el quemado grave
Una importante revisión de Jescke (5) describe estos cambios frente a la quemadura, los cuales están mediados por hormonas contra reguladoras: glucagón, adrenalina, noradrenalina, hormona del crecimiento, y glucocorticoides y por otro lado citoquinas pro inflamatorias (IL-6, IL-1, TNFα), lo cual genera una respuesta hipermetabólica e hipercatabólica profunda y sostenida en el tiempo (5). En niños quemados, también estudió estas alteraciones metabólicas en grasas y carbohidratos, así como la resistencia insulínica, demostrando que pacientes con mayores niveles de citoquinas e inflamación tenían peor sobrevida (6).
Rol del profesional
El tratamiento del paciente quemado es un ejemplo claro de necesidad de trabajo interdisciplinario en donde debería estar presente el profesional de la Nutrición.
Czapran demostró que pacientes quemados graves en asistencia respiratoria mecánica no reciben la cantidad de energía y proteínas necesarias y esto es significativamente menor en los no sobrevivientes (7). Sudenis, observó similares resultados y halló que la nutrición enteral (NE) era suspendida por múltiples causas evitables (8). Este tipo de estudios han jerarquizado el rol del profesional de la Nutrición en las UCI al demostrar que su presencia en el equipo mejora los resultados de la TN del paciente y su evolución (9). Para el caso de pacientes con COVID – 19, se requiere establecer protocolos de servicio de comidas y bebidas, uso de vajilla, así como normas de circulación dentro del sector asignado, uso de EPP acorde a la tarea a realizar, todo lo cual será supervisado por el Lic. en Nutrición.
Recomendación 1. Todo centro que asista pacientes quemados deberá contar con un equipo profesional interdisciplinario integrado, entre otros, por Lic. en Nutrición en forma estable.
Tamizaje nutricional
La evaluación del riesgo nutricional debe realizarse de forma precoz, para poder priorizar pacientes en riesgo o desnutridos que presentarán peor pronóstico y mayor mortalidad por infección de SARS-COV-2 (2). Todo paciente que deba permanecer en UCI más de 48 horas se considera en riesgo nutricional y debe recibir TN. Si a eso se agrega la infección por SARS-COV-2, se concluye que no sería necesario realizar tamizaje.
Valoración objetiva del estado nutricional
En los pacientes quemados la valoración nutricional está limitada, pues los indicadores habituales dan resultados confusos por la respuesta inflamatoria o no pueden aplicarse por la propia patología.
Antropometría. Los indicadores a considerar son: peso, talla e IMC. La pesada será diaria en la etapa crítica, luego semanal. Otras medidas como circunferencia o pliegues no tienen utilidad.
En el caso de los niños se utilizan las curvas de crecimiento en percentiles de la OMS. Los puntos de corte en percentiles son: normal, entre 5-85, desnutrición, <5 y sobrepeso-obesidad >85.
El peso tiene limitaciones, ya que no discrimina cuál es el compartimento corporal afectado. Además, en la fase temprana aumenta la permeabilidad capilar pasando líquido al espacio extravascular, con formación de edema que eleva el peso corporal (10). El peso es útil en lo inmediato para evaluar la reposición hídrica y a mediano y largo plazo para evaluar la TN realizada. Se acepta un valor entre 90 y 110 % del peso inicial, como un indicador de TN óptima (11).
En pacientes con COVID 19, a pesar del riesgo de exposición, se deberá contar con el peso para planificar la reposición hidroelectrolítica y otros cálculos. Es útil disponer de camas balanza.
Recomendación 2. Se debe obtener el peso del paciente al ingreso por pesada o referencia del familiar y luego controlarlo diariamente mientras dure la etapa crítica y luego semanalmente.
Parámetros bioquímicos. Proteínas séricas
Las concentraciones plasmáticas de ciertas proteínas reactantes de fase aguda sintetizadas por el hígado, como albúmina, transferrina, prealbúmina y la proteína ligadora del retinol, han sido usadas como marcadores nutricionales en niños y adultos. Durante el estado inflamatorio la síntesis está disminuida por lo que no reflejan el estado nutricional sino la gravedad de la injuria. La albúmina además tiene larga vida media y se altera por factores no nutricionales como infecciones, pasaje al espacio extracelular, dilución por fluidos infundidos.
La prealbúmina es la más sensible por tener un pool pequeño y vida media de dos días. Sin embargo, sus cambios tampoco son específicos del estado nutricional. Se han hallado valores bajos más allá del día 14-17 pos quemadura, asociados con mayor incidencia de sepsis, estadía más prolongada, menor cicatrización y sobrevida (12,13). Los niveles de prealbúmina son inversamente proporcionales a niveles aumentados de proteína C reactiva (PCR), característico en la inflamación (13).
Recomendación 3. Salvo la pre albúmina, los marcadores bioquímicos no sirven para evaluar estado nutricional. En caso de uso se relacionará con la PCR.
Requerimiento energético
La respuesta hipermetabólica (aumento del gasto energético) e hipercatabólica es proporcional a la intensidad de la quemadura y puede extenderse durante meses. No existen datos aún de requerimientos en pacientes quemados con COVID – 19 pero se presumen muy elevados por la propia patología y comorbilidades asociadas. La elevación del gasto energético actualmente es menor por cambios en el tratamiento. El más importante es la escisión temprana de la quemadura (14), la cual evitará la producción de mediadores pro inflamatorios y pérdidas de calor por evaporación.
Otras estrategias han sido, elevar a 33° la temperatura ambiente (15), controlar dolor y ansiedad, fármacos como betabloqueantes (16,17), propranolol (18, 19), oxandrolona (20-21). En niños exclusivamente, la hormona del crecimiento recombinante, mostró beneficios en déficit del crecimiento y cicatrización (22).
La calorimetría indirecta (CI) es el método ideal para determinar el gasto energético, sabiendo que tanto el exceso como el déficit son perjudiciales. Desafortunadamente, el costo del equipo hace que no siempre esté disponible y en COVID – 19 obliga a desinfección cuidadosa del mismo. Cuando no se dispone de CI, se recurrirá a fórmulas predictivas que toman en cuenta peso, talla y SCQ. Resultan imprecisas, estáticas, al no considerar evolución y sobrestiman el gasto energético. La de Curreries es la que más sobreestima y no debería usarse. La fórmula de Toronto (23), es más dinámica y correlaciona mejor con la CI. Ha sido propuesta en la última guía consultada (24). Durante situaciones de gran carga laboral, como la actual pandemia, es útil el método rápido de kcal/ kg de peso inicial según SCQ (25).
En niños (26), se recomienda fórmula de Schofield (27), OMS (28), aplicando corrección de 30 % por subestimación del gasto; también se puede usar Toronto.
Recomendación 4. En ausencia de CI, la meta calórica se calculará en adultos por fórmula de Toronto. Otra alternativa es usar kcal/kg/día según SCQ. En niños se usará fórmula de Schofield u otras de uso en pediatría, con incremento de 30 % (Ver cuadro 1).
Necesidad proteica
La pérdida proteica primero en el músculo esquelético, para gluconeogénesis puede ser de 1 kg /día, 16 % del total en los primeros 21 días, pese a adecuada TN (25).
El requerimiento proteico en adultos es de 1.5 a 2 g/k/día (1, 2, 24, 29). Aportes superiores no tienen beneficios (24,25). El peso a usar es el del ingreso (seco) o peso ajustado en obesos. En niños, se recomienda 2.5 a 4 g/kg/día, aunque más de 3g/kg/día no han mostrado beneficios (30).
Van Zanten (31) observó mejor sobrevida en pacientes críticos cuando el aporte proteico era gradual: g/kg/día: días 1-2, < 0.8, día 3 a 5: 0.8 – 1.2 y luego del día 5, > 1.2. La mayor mortalidad puede estar ligada a inhibición del mecanismo de autofagia por aporte nutricional agresivo.
El balance nitrogenado se usa para verificar la adecuación de la TN realizada, (el balance depende también del ingreso calórico) y para cuantificar el catabolismo existente. En el quemado es necesario calcular las pérdidas de proteínas a través de SCQ. Waxman (32) las midió y el cálculo se realiza según fórmula. (Ver cuadro 2.)
El paciente añoso, poli mórbido es el más afectado por COVID – 19 y es sabido el riesgo nutricional potencial, unido a sarcopenia habitual, por lo que se debe tener presente el aporte proteico.
Un programa equilibrado y precoz de ejercicios pasivos y activos es necesario para complementar la ingesta proteica y lograr mantener y recuperar la masa magra corporal y la función.
Recomendación 5. La necesidad proteica en g/k/día se considera 1.5 a 2 en adultos y 2.5 a 4 .0 en niños. El aporte será gradual. El peso será el del inicio o ajustado en obesos.
El balance nitrogenado debe incluir pérdidas por la herida quemadura.
Se recomienda implementar un plan de ejercicios precoz, adecuado a estado del paciente.
Glutamina y Arginina
La glutamina, aminoácido (AA) condicionalmente esencial para los quemados, baja drásticamente pos injuria. Espen (2) recomienda aportar 0.3 g/k/día en los primeros 10 – 15 días, en quemados y trauma. No hay consenso sobre dosis, vía y duración del aporte. Heyland (33) está realizando un estudio multicéntrico con 0.5 g /kg/día, cuyos resultados aclararán beneficios de este controversial nutriente inmuno modulador. Una alternativa es la ornitina alfa cetoglutarato, precursor de la glutamina, en dosis de 30 g día (34, 35).
La arginina, AA importante en la cicatrización, no está recomendada para quemados por insuficiente evidencia (24). En otros pacientes críticos se recomienda 30 g / día (2).
Recomendación 6. Existe controversia respecto al aporte de glutamina. Mientras se espera nueva evidencia, se puede administrar en quemados > 20 % SCQ, 0.3 – 0.5 g/kg/día. La arginina no debería usarse de rutina por falta de evidencia.
Carbohidratos
Son el combustible preferencial para células de la cicatrización y del tejido vinculado a la inflamación. En la injuria la tasa de oxidación de glucosa aumenta 130 % y la administración exógena no frena la producción por gluconeogénesis (25).
Se recomienda 60 – 65 % de las calorías como carbohidratos, sin superar 7 g /kg/ día.
El control de la glicemia recomendado para críticos también es importante en el paciente quemado grave, pero el objetivo estricto de 4 – 6.1 mmol/litro (72 a 108 mg/dl) no ha mostrado beneficio (25). Por otra parte, el quemado tiene mayor riesgo de hipoglicemia por elevados requerimientos. Cochran (36) demostró que la meta de < 8 mmol/litro (144 mg/dl) es segura, asociándose a mejor resultado en infecciones e injertos. Similares resultados obtuvo Stoecklin (37). Herdorn, en 760 niños, con control insulínico, halló hipoglicemia en 14.2 % de los casos, asociado a mayor mortalidad (38).
Recomendación 7. Aportar 60 – 65 % de las calorías como carbohidratos sin superar 7 g/k/día. Mantener glicemia < 8 mmol/litro(144 mg/dl). En niños monitorear estrechamente la glicemia.
Grasas
En los 80-90s, estudios en niños demostraron beneficios de bajar el aporte lipídico, reduciendo infecciones y estadía (39). Se recomienda aportar menos del 30 % del total calórico (25). Garrel (40) ha recomendado menor cantidad aún, 20 %. Aportes tan bajos, son infrecuentes en dietas comerciales, lo cual muchas veces lleva a elaborar fórmulas modulares en el propio hospital (25).
En Uruguay, desde 1995, se usa dieta modular similar a la de los Shriners Hospital for Children (11) y de centros de quemados de adultos en EEUU (41). Teniendo en cuenta riesgos de administración en ambientes cálidos, se deben protocolizar elaboración, administración y controles bacteriológicos (41).
Hay poca evidencia de omega 3 en adultos quemados. En ensayo clínico en 92 pacientes (42), con dieta elaborada en el centro con 18 % de grasa, mitad aceite de girasol y mitad de pescado, se hallaron menos complicaciones, resultando significativas sepsis y retención gástrica. Siendo el COVID 19 un estado hiperinflamatorio, es atractivo usar ácidos grasos omega 3, de efecto anti inflamatorio.
Recomendación 8. El aporte de grasas será < 30 % de grasa y menos aún. Sería beneficioso el mayor aporte de omega 3. Si no hay disponibilidad de este tipo de fórmulas enterales, se pueden elaborar en el servicio bajo estrictas condiciones de higiene y controles microbiológicos.
Micronutrientes
Los quemados presentan bajos niveles en sangre de varios elementos traza (ET), debido a excreción urinaria, pérdida de líquidos y micronutrientes a través de las cirugías y exudación de la quemadura, que se prolongan hasta el cierre de la herida. Esto genera deficiencia de ET que afecta la evolución con más infecciones y retraso en la curación. Los ET más estudiados son cobre (Cu), selenio (Se) y zinc (Zn), cuyas pérdidas son máximas en la primera semana (43, 44).
Jafari (45) midió mediante un sistema de presión positiva el contenido en exudados de doce ET.
En niños se ha demostrado que niveles bajos de ET y vitaminas, A, C, D afectan la evolución.
Existe controversia en cuanto a dosis, vía de administración y duración del aporte.
Recomendación 9. Corregir bajos niveles de ET resultantes de pérdidas, principalmente por superficie exudativa. Se deberá disponer de protocolo para corregir o prevenir deficiencia. Como mínimo se deberá administrar vía intravenosa, Cu, Se y Zn. (Ver cuadro 1)
Vitaminas
No se conoce con exactitud su necesidad, pero se presume está muy aumentada. Aparte de su rol nutricional, se vinculan con la inmunidad y función antioxidante, fundamental en el quemado que desarrolla producción aumentada de radicales libres. La vitamina C ha sido muy estudiada y se demostró que baja la necesidad de fluido en la resucitación (46).
Importa aportar y cubrir requerimientos principalmente de vitamina C, A, D, E y complejo B (47, 48).
Recomendación 10. Se deben prevenir y corregir niveles vitamínicos insuficientes. (Ver cuadro 1).
Vía enteral (NE)
Será la vía de elección en el paciente grave donde la nutrición oral es imposible o insuficiente. El acceso gástrico es seguro, sobre todo en el paciente con COVID – 19, pues requiere menos manipulación y control. Una sonda más gruesa, evitará necesidad de recambios y permitirá administración de fármacos con menor riesgo de obstrucción. La ruta yeyunal se destinará para casos de intolerancia digestiva, ya que retrasa el inicio de la NE y genera más exposición al personal.
Recomendación 11. La vía de elección será gástrica por ser más fácil de colocar, permitir un comienzo más rápido y con menor riesgo de obstrucción.
Método de administración de la NE
Debe ser continua o cíclica en 16 a 20 horas. Esta última permite dejar horas libres para frecuentes cirugías, balneoterapias y otros procedimientos. Bajos volúmenes de infusión iniciales (10 -20 cc /hora) o altos en la evolución requieren bomba de infusión.
Recomendación 12. Usar método de administración continuo o cíclico con bomba de infusión.
Comienzo de la NE
ASPEN (1) recomienda comenzar 4 – 6 horas pos injuria, ESPEN (2) antes de 12 horas y la guía ISBI (29), establece comenzar durante la resucitación, sin establecer horarios.
La NE temprana se recomienda en niños y adultos pues se ha demostrado mejorar sobrevida e infecciones (24). Se inicia a baja velocidad, 20 cc / hora (trófica). En inestabilidad hemodinámica severa o dosis crecientes de vasopresores no debería comenzar la NE.
Recomendación 13. Comenzar la NE antes de 12 horas del ingreso. La hemodinamia no es una contraindicación total. Según parámetros podrá comenzarse con nutrición trófica, con aumento gradual y estrecho monitoreo de la tolerancia. Es igual en pacientes con COVID – 19.
Nutrición enteral en posición prono
Esta posición en hipoxemia refractaria, frecuente en pacientes con COVID – 19, mejora oxigenación y secreciones bronquiales. La NE no está contraindicada, si bien puede presentar complicaciones que se pueden prevenir. Se usa la vía gástrica, pero en caso de aumento del residual gástrico se puede pasar a vía yeyunal (49).
Recomendación 14. En posición prono se podrá usar la NE. Para menor riesgo de aspiración, menor edema facial e hipertensión intra abdominal, se recomienda colocar al paciente en Trendelemburg invertido, (cabecera levantada 10 a 25 °) y proquinéticos desde el inicio.
Selección de la fórmula enteral
Los pacientes quemados toleran dietas poliméricas. Deberán ser hiperproteicas e hipograsas. No se indicarán de rutina fórmulas específicas como oligoméricas, inmunomoduladoras, respiratorias, (bajas en carbohidratos, ricas en grasa), las cuales son costosas. Al inicio serán de densidad calórica de 1 kcal/ cc y sin fibra pues pueden no ser toleradas.
En niños, la leche fue el alimento usado en los 70s. Luego se la consideró una dieta rica en grasa a la luz de estudios sobre beneficios de bajar este nutriente. Se usa gran variedad de dietas comerciales (26) con grasa entre 3 – 42 %, inmunoestimulante y variantes de la modular ya mencionada (11).
Según aporte de la dieta, se complementa con bolos de proteína usando caseína o proteína del suero de leche. Ambas de buena calidad y digestibilidad, la segunda de mejor absorción. Es necesario sistematizar contenido proteico del bolo, elaboración, envasado, rotulado, horario y administración.
Recomendación 15. En adultos se recomiendan de inicio dietas poliméricas, hiperproteicas, bajas en grasas. En niños existe controversia en relación a la dieta ideal. De ser necesario se puede recurrir a bolos proteicos para cumplir la meta proteica.
Nutrición vía oral
En el paciente grave es usada luego de la desvinculación de la asistencia respiratoria mecánica. En el paciente con COVID – 19, con insuficiencia respiratoria dependerá del soporte ventilatorio, cánula de alto flujo o ventilación no invasiva (VNI.) Se ha demostrado que muchas veces el paciente con VNI no recibe lo indicado (50), por lo que es necesario monitorear la ingesta y, de no cubrir 70 % de la meta, usar suplementos. Si permanece insuficiente se deberá reinstalar la NE. Pos intubación prolongada como se observa en pacientes con COVID – 19 puede aparecer disfagia que requiere cambios en la dieta, líquidos espesados y consulta con especialista.
Recomendación 16. Todo paciente que ingiera menos del 70 % de sus requerimientos deberá recibir suplemento oral adecuado a ingesta o NE complementaria.
Nutrición parenteral
Debería considerarse precozmente si en la primera semana no se cubrieron requerimientos, o por imposibilidad de usar el tubo digestivo. Existe mayor riesgo de infección por lo que debe protocolizarse estrictamente su uso.
Recomendación 17. La nutrición parenteral total o complementaria deberá implementarse precozmente, bajo estrictos protocolos, cuando la vía digestiva es imposible o insuficiente.
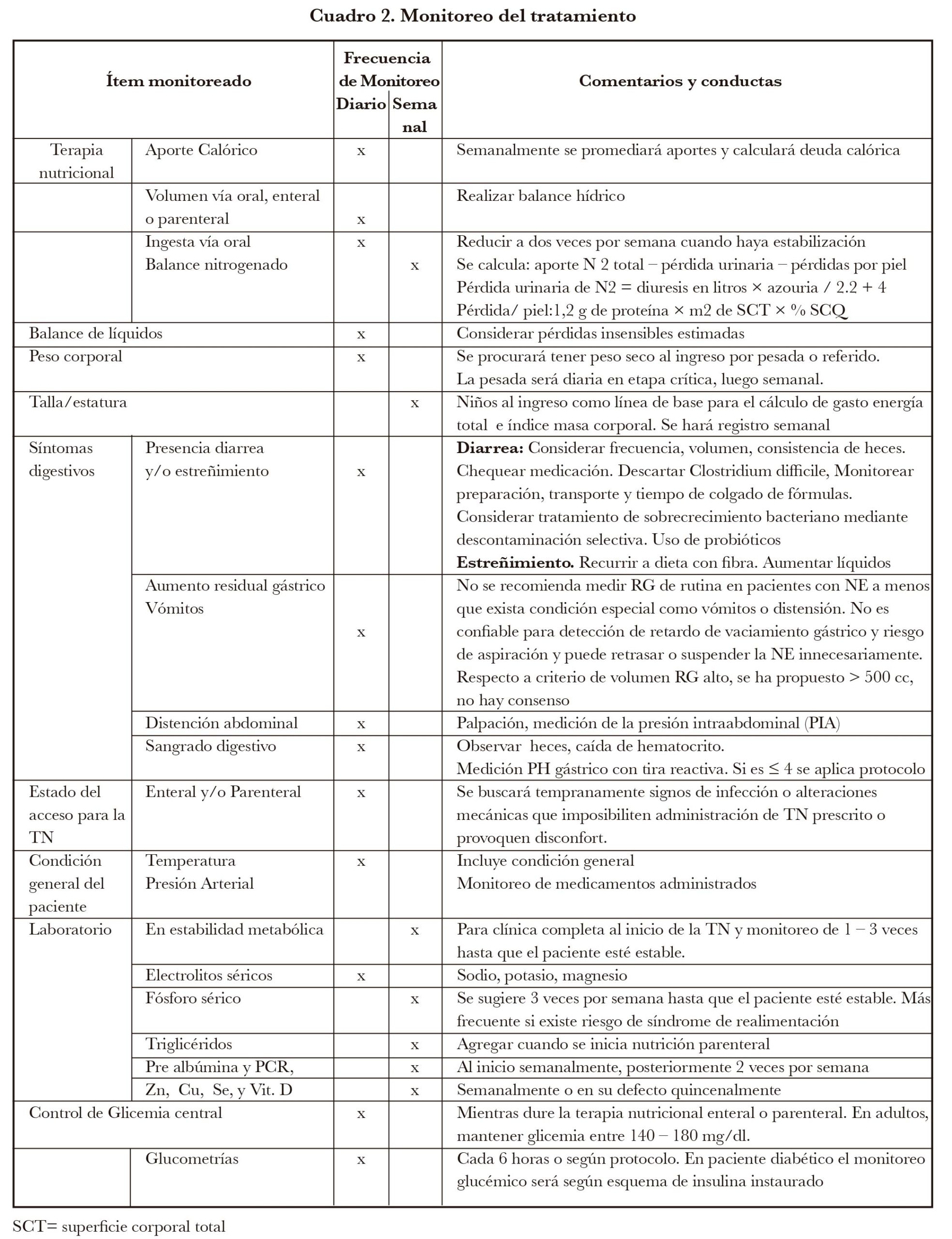
Monitoreo de la terapia nutricional
Es fundamental monitorear respuesta a la TN. Berger et al (51) proponen el POE (Procedimientos Operativos Estándar) que son un conjunto de instrucciones paso a paso que tienen como objetivo brindar atención de manera eficiente y reducir el riesgo de un evento no deseado. Ayuda a los profesionales a realizar operaciones complejas de rutina, al tiempo que logran eficiencia y calidad. El Lic. en Nutrición es clave pues muchos indicadores están dentro de sus competencias y posee los datos necesarios.
Recomendación 18. Realizar monitoreo de la TN según indicadores y frecuencia establecida.
Servicios de Alimentación durante pandemia
Deberán desarrollar protocolos para prevenir contagio con SARS CoV-2. El personal del sector deberá tener buenas prácticas de higiene, como lavado de manos. La circulación en áreas de pacientes con COVID -19, debe estar clara para reducir exposición. El personal de Nutrición no ingresará al área. Comidas y bebidas se servirán en material descartable y será personal de Enfermería quien las brinde al paciente. El Lic. en Nutrición se comunicará por medios virtuales para obtener información del paciente y del tratamiento. La historia electrónica facilita el trabajo. Cada servicio debe resolver esta limitante. Respecto a EPP, el personal que no tomará contacto con el paciente usará el equipo habitual: pantalón y casaca, gorros y guantes descartables, mascarilla quirúrgica. De ser necesario, se le proveerá EPP completo.
Recomendación 19. Se deberá contar con protocolos que contemplen las distintas operaciones relacionadas a la alimentación de los pacientes, así como circulación y uso de EPP adecuado.

Bibliografía
- McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al.; Society of Critical Care Medicine; American Society for Parenteral and Enteral Nutrition. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr. 2016 Feb;40(2):159-211.
- Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38:48-79.
- Barazzoni R et al. ESPEN experts statements and practical guidance for nutritional management of individual with SARS CoV-2 infection. Clinical Nutrition, https://doi.org/10.1016/j.clnu.20202.03.022.
- Martindale R et al. Nutrition Therapy in the Patient with COVID-19 Disease Requiring ICU Care. Updated March 30, 2020.
- Jesckke MG. Postburn Hypermetabolism: Past, Present and Future. J Burn Care & Res 2016; 37:86-96.
- Jeschke MG, Gauglitz GG, Finnerty CC, et al. Survivors versus nonsurvivors postburn: differences in inflammatory and hypermetabolic trajectories. Ann Surg 2014; 259:814–823.
- Czapran A, Headdon W, Deane AM, et al. International observational study of nutritional support in mechanically ventilated patients following burn injury. Burns 2015; 41:510–518.
- Sudenis T, Hall K, Cartotto. Enteral Nutrition: What the Dietitian Prescribes Is Not What the Burn Patient Gets! J Burn Care Res Mar-Apr 2015; 36(2):297-305.
- Terblanche The role of dietitians in critical care. J Intensive Care Soc. 2019 Aug;20(3): 255–57.
- Warden G. Fluid resuscitation and early management. In book: Total Burn Care, Herdorn DN editor 3aed London; WB Saunders, 1997 p 53 – 60.
- Mayes T, Gottschlich M. Burns in contemporary nutrition support practice. En Matarese L, Gottschlich M, editors. Contemporary nutrition support practice: a clinical guide. Philadelphia: WB Saunder Company; 1998. P 590 – 607.
- Cynober L, Prugnaud O, Lioret N, Duchemin C, Saizy R, Giboudeau J. Serum transthyretin levels in patients with burn injury. Surgery, 1991, 109: 640-644.
- Beck FK, Rosenthal TC. Prealbumin: a marker for nutritional evaluation. Am FamPhysician, 2002, 65: 1575-1578.
- Hart DW, Wolf SE, Chinkes DL, Beauford RB, Mlcak RP, Heggers JP, et al. Effects of early excision and aggressive enteral feeding on hypermetabolism, catabolism, and sepsis after severe burn. J Trauma 2003; 54:755-61.
- Wilmore DW, Mason Jr AD, Johnson DW, Pruitt Jr BA. Effect of ambient temperature on heat production and heat loss in burn patients. J Appl Physiol 1975 Apr; 38 (4): 593 -7.
- Herndon DN, Wolf SE, Chinkes DL, Wolfe RR. Reversal of catabolism by betablockade after severe burns. N Engl J Med 2001; 345:1223-9.
- Flores O, Stockton K, Roberts JA, et al. The efficacy and safety of adrenergic blockade after burn injury: a systematic review and meta-analysis. J Trauma Acute Care Surg 2016; 80:146–155.
- Mohammadi AA, Bakhshaeekia A, Alibeigi P, Hasheminasab MJ, Tolide-ei HR,Tavakkolian AR, et al. Efficacy of propranolol in wound healing for hospitalized burn patients. J Burn Care Res 2009; 30:1013-7.
- Ali A, Herndon DN, Mamachen A, et al. Propranolol attenuates hemorrhage and accelerates wound healing in severely burned adults. Crit Care 2015; 19:217.
- Wolf SE, Edelman LS, Kemalyan N, Donison L, Cross J, Underwood M, et al. Effects of oxandrolone on outcome measures in the severely burned: a multicenter prospective randomized double-blind trial. J Burn Care Rehabil 2006; 27:131-9.
- Demling RH, Orgill DP. The anticatabolic and wound healing effects of the testosterone analog oxandrolone after severe burn injury. J Crit Care 2000; 15:12-7.
- Herndon DN, Hawkins HK, Nguyen TT, Pierre E, Cox R, Barrow RE. Characterization of growth hormone enhanced donor site healing in patients with large cutaneous burns. Ann Surg 1995; 221:649 -59.
- Allard JP, Pichard C, Hoshino E, Stechison S, Fareholm L, Peters W, et al. Validation of a new formula for calculating energy requirements of burn patients. JPEN 1990; 14:115-8.
- Rousseau AF, Losser MR, Ichai C, Berger MM. ESPEN endorsed recommendations: nutritional therapy in major burns. Clin Nutr 2013; 32:497–502.
- Berger MM, Pantet O. En Basics in Clinical Nutrition. Fifth Edition.by Luboš Sobotka (editor) Espen Book 2019. 477- 485.
- RodriguezNA, Jeschke MG, Williams FN, Kamolz L-P, Herndon DN. Nutrition in Burns: Galveston Contributions. J Parenter Enteral Nutr. 2011 Nov;35(6):704-14.
- Schofield WN. Predicting basal metabolic rate, new standards and review of previous work. Hum Nutr Clin Nutr1985; 39:5-41.
- FAO/WHO/UNU. Energy and protein requirements. Report of a joint FAO/WHO/UNU Expert Consultation. World Health Organization Technical Report Series no. 724, 1985.
- Comité de Guías de Práctica Clínica de la ISBI. Subcomité de Dirección: Ahuja R, Gibran N, Greenhalgh D, Jeng J, Mackie D, Moghazy A, Moiemen N, Palmieri T, Peck M, Serghiou M, Watson S, Wilson I, Guía de Práctica Clínica de la ISBI para el Cuidado de las Quemaduras BURNS 42 (XXXX)1-76.
- Neil CE, Hustler D, Hildreth MA. Basics nutritional guidelines for pediatric burn patients. J Burn Care Rehabil 1989; 10:278-84.
- Koekkoek K, van Setten CCH, Olthof LE, Kars JCN, van Zanten ARH. Timing of PROTein INtake and clinical outcomes of adult critically ill patients on prolonged mechanical VENTilation: the PROTINVENT retrospective study. Clin Nutr. 2019 Apr;38(2):883-890.
- Waxman K, Rebello T, Pinderski L et al. Protein loss across burn wounds. J Trauma, 1987:136-140.
- Heyland D. The Effect of High Protein Dosing in Critically Ill Patients: A Multicenter Registry-based Randomized Trial. The EFFORT Trial.
- De Bandt JP, Coudray-Lucas C, Lioret N, Lim SK, Saizy R, Giboudeau J, et al. A randomized controlled trial of the influence of the mode of enteral ornithine a-ketoglutarate administration in burn patients. J Nutr 1998; 128:563 -8.
- LeBricon T, Coudray-Lucas C, Lioret N, Lim SK, Plasart F, Schlegel L, et al. Ornithine a-ketoglutarate metabolism after enteral administration in burn patients: bolus compared with continuous infusion. Am J Clin Nutr 1997; 65:512-8.
- Cochran A, Davis L, Morris S, Saffle J. Safety and efficacy of an intensive insulin protocol in a burn – trauma intensive care unit. Journal of burn care & research: official publication of the American Burn Association 2008; 29:187-91.
- Stoecklin P, Delodder F, Pantet O, Berger M. Moderate glycemic control safe in critically ill adult burn patients: a 15year cohort study. Burns 2016; 42: 63-70.
- Jeschke MG, Pinto R, Herdorn DN et al. Hypoglycemia is associated with increased postburn morbidity and mortality in pediatric patients. Crit Care Med 2014; 42:1221-1231.
- Gottschlich MM, Jenkins M, Warden G, Mayes T, Baumer T, Havens P, Snook J, Alexander W. Differential Effects of Three Enteral Dietary Regimens on Selected Outcome Variables in Burn Patients. Journal of Parenteral and Enteral Nutrition 1990; 14: 225–236.
- Garrel DR, Razi M, Larivière F, Jobin N, Naman N, Emptoz-Bonneton A, et al. Improved clinical status and length of care with low-fat nutrition support in burn patients. J Parenteral Enteral Nutr 1995; 19:482-91.
- Akers K, Shields B, Akers M, Mende K, Beckius M, Murray C, Chung K. Microbial Contamination of Enteral Nutrition Mixtures in a Hyperthermal Environment: A Follow – Up Investigation. Nutr Clin Pract. 2015; 30: 582 – 584.
- Tihista S, Echavarría E. Effect of omega 3 polyunsaturated fatty acids derived from fish oil in major burn patients: a prospective randomized controlled trial. Clin Nutr 37 (2018) 107-112.
- Berger MM, Eggimann P, Heyland DK, Chioléro RL, Revelly JP, Day A, et al. Reduction of nosocomial pneumonia after major burns by trace element supplementation: aggregation of two randomized trials. Crit Care 2006;10: R153. e-pub 2 Nov.
- Berger MM, Baines M, Raffoul W, Benathan M, Chiolero RL, Reeves C, et al. Trace element supplements after major burns modulate antioxidant status and clinical course by way of increased tissue trace element concentrations. AmJ Clin Nutr 2007; 85: 293-300.
- Jafari P, Thomas A, Haselbach D, Watfa W, Pantet O, Michetti M, Raffoul W, Applegate LA, Augsburger M, Berger MM. Trace Element Intakes Should Be Revisited in Burn Nutrition Protocols: A Cohort Study. Clin Nutr 2018 Jun;37: 958-964.
- Tanaka H, Matsuda T, Miyagantani Y, Yukioka T, Matsuda H, Shimazaki S. Reduction of resuscitation fluid volumes in severely burned patients using ascorbic acid administration. Arch Surg 2000; 135:326-31.
- Barbosa E, Faintuch J, Machado Moreira EA, Goncalves da Silva VR, Lopes Pereima MJ, Martins Fagundes RL, et al. Supplementation of vitamin E, vitamin C, and zinc attenuates oxidative stress in burned children: a randomized, double-blind, placebo-controlled pilot study. J Burn Care Res 2009; 30:859 -66.
- Klein GL, Herndon DN, Chen TC, Kulp G, Holick MF. Standard multivitamin supplementation does not improve vitamin D insufficiency after burns. J Bone Miner Metab 2009; 27:502-6.
- Reignier J, Thenoz-Jost N, Fiancette M, Legendre E, Lebert C, Bontemps F, Clementi E, Martin – Lefebre L. Early enteral nutrition in mechanically ventilated patients in the prone position. Crit Care Med. 2004; 32: 94-9.
- Reeves A et al. Energy and protein intakes of hospitalized patients with acute respiratory failure receiving non-invasive ventilation. Clin Nutr 2014; 33(6):1068–1073.
- Berger MM, Reintan – Blaser A, Calder P, van Zanten A, Bischoff S, Singer P. Monitoring nutrition in the ICU, ClinNutr2019; 38: 584-593.

